
【题目】汽车尾气中NO产生的反应为:N2(g)+O2(g)![]() 2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
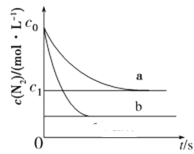
A.温度T下,该反应的平衡常数![]()
B.温度T下,随着反应的进行,混合气体的密度不变
C.曲线b对应的条件改变可能是增大压强
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
【答案】C
【解析】
A选项,
N2(g) + O2(g) ![]() 2NO(g)
2NO(g)
起始量 c0 mol/L c0 mol/L 0
转化量 (c0-c1)mol/L (c0-c1)mol/L 2(c0-c1)mol/L
平衡量 c1 mol/L c1 mol/L 2(c0-c1)mol/L
![]()
故A正确;
B选项,混合气体的密度![]() ,随着反应的进行,气体质量没变,容器体积未变,因此混合气体的密度不变,故B正确;
,随着反应的进行,气体质量没变,容器体积未变,因此混合气体的密度不变,故B正确;
C选项,曲线b对应的条件改变如果增大压强,则平衡不移动,氮气的浓度不改变,而图像氮气的浓度发生改变,故C错误;
D选项,若曲线b对应的条件改变是温度,根据先拐先平衡,数字大,即b曲线对应的温度高,从下往上,降低温度,向放热反应移动,氮气浓度升高,逆向移动,即逆向为放热,正向为吸热反应即ΔH>0,故D正确;
综上所述,答案为C。


 互动英语系列答案
互动英语系列答案科目:高中化学 来源: 题型:
【题目】一定条件下合成乙烯:6H2(g)+2CO2(g)![]() CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )
CH2===CH2(g)+4H2O(g);已知温度对CO2的平衡转化率和催化剂催化效率的影响如图,下列说法不正确的是( )

A. 该反应的逆反应为吸热反应
B. 平衡常数:KM>KN
C. 生成乙烯的速率:v(N)一定大于v(M)
D. 当温度高于250 ℃,升高温度,催化剂的催化效率降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A.甲烷的燃烧热为890.3kJ/mol,则甲烷燃烧的热化学方程式可表示为CH4(g)+2O2(g)![]() CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
CO2(g)+2H2O(g) ΔH=-890.3kJ/mol
B.在200℃、101KPa时,H2与碘蒸气作用生成1 mol HI放出热量7.45kJ,其热化学方程式为I2(g)+H2(g)=2HI(g) ΔH=-14.9kJ/mol
C.已知在101kPa下,1gH2燃烧生成水蒸气放出121kJ热量,其热化学方程式为H2(g)+![]() O2(g)=H2O(g) ΔH=-242kJ/mol
O2(g)=H2O(g) ΔH=-242kJ/mol
D.25℃,101kPa时,强酸与强碱的稀溶液发生中和反应的中和热为57.3kJ/mol,表示硫酸溶液与氢氧化钾溶液反应的中和热的热化学方程式为H2SO4(aq)+2KOH(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】启普发生器是荷兰科学家设计的实验室气体发生装置,由图中漏斗1和容器2两部分构成;现借助启普发生器及相关装置模拟侯氏制碱法制备日用化学品——NH4Cl和Na2CO3。回答相关问题:
(NaHCO3的制备)
反应原理:NH3+NaCl+CO2+H2O=NH4Cl+NaHCO3↓
反应装置:

(1)启普发生器中发生的离子反应方程式为___,如果上述装置中导管被堵塞,启普发生器中观察到的现象是___。
(2)仪器3中盛装的试剂是___;已知常温,NaCl的溶解度为35.9g,仪器4中含氨的饱和食盐水的配制方法是将20.0mL浓氨水与8.0gNaCl混合振荡过滤,试推测过滤除去的物质为___。
(3)观察仪器4中CO2流速的方法是___,仪器5中试剂的作用是___。
(4)反应结束后,对仪器4进行冷却并趁冷过滤其中的悬浊液,“趁冷”的目的是___。
(Na2CO3的制备)
(5)将(4)所得固体转移至蒸发皿中加热得到Na2CO3;请设计简单实验证明NaHCO3固体已分解完全___。
(NH4Cl的制备)
(6)向(4)所得母液中加入两种物质并降温,NH4Cl会逐步结晶析出,所加物质的名称是___,过滤NH4Cl晶体后的滤液可以再次循环使用。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在2L恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平均反应速率为0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2A(g)B(g)。分别取1molA于2L的固定体积的容器中,分别在T1和T2下,测得A的转化率随时间变化的关系曲线如图所示。下列说法正确的是

A.升高温度可缩短反应到达平衡的时间同时能提高A平衡的转化率
B.从反应开始至40min时,T2温度下生成B的物质的量比T1温度下多
C.图中a、b、c三点的化学反应速率依次减小
D.用B表示T1温度下前40min的平均反应速率:v(B)=0.0025molL﹣1min﹣1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH__0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol/(L·s);反应的平衡常数K1为_____。

(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T___100℃(填“大于”或“小于”)
②计算温度T时反应的平衡常数K2为_____。
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:
C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g)ΔH=﹣283kJ·mol-1
O2(g)=CO2(g)ΔH=﹣283kJ·mol-1
根据上述信息,写出C转化为CO的热化学方程式___。
(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=﹣241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为___kJ·mol-1
O2(g)=H2O(g) ΔH=﹣241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为___kJ·mol-1
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=﹣574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=﹣1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为___(用阿伏加德罗常数NA表示),放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】奥司他韦是一种高效、高选择性神经氨酸酶抑制剂,是目前治疗流感的最常用药物之一,是公认的抗禽流感、甲型H1N1等病毒最有效的药物之一. 也是国家的战略储备药物。也有专家尝试使用奥司他韦作为抗新现冠状病毒肺炎药物。奥司他韦的合成路线如下:
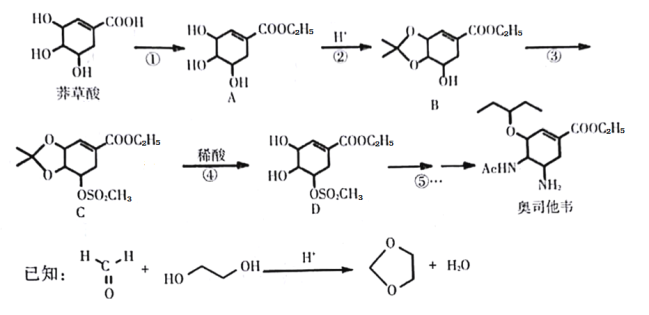
回答下列问题:
(1)莽草酸的含氧官能团名称为:___________
反应③的反应类型:__________________。
(2)反应①的反应试剂和反应条件:________________________________。
(3)请写出反应②的化学方程式:__________________________________。
(4)芳香化合物X是B的同分异构体,则符合官能团只含酚羟基的X有_____种。
(5)碳原子上连有4个不同的原子或基团时,该碳称为手性碳。C中有_____个手性碳。
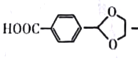
(6)设计由对甲基苯甲醛![]() 制备对醛基苯甲酸
制备对醛基苯甲酸![]() 的合成路线如下图所示。
的合成路线如下图所示。
![]()
![]() M
M![]()
![]()
![]()
写出M结构简式__________________,条件1为_______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com