
����Ŀ����1����֪��
C��s��+O2��g��=CO2��g�� ��H=��393.5kJ��mol��1
CO��g��+![]() O2��g��=CO2��g����H=��283kJ��mol��1
O2��g��=CO2��g����H=��283kJ��mol��1
����������Ϣ��д��Cת��ΪCO���Ȼ�ѧ����ʽ___��
��2����֪�Ȼ�ѧ����ʽ��H2��g��+![]() O2��g��=H2O��g�� ��H=��241.8 kJ��mol��1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1�������淴Ӧ�Ļ��Ϊ___kJ��mol��1
O2��g��=H2O��g�� ��H=��241.8 kJ��mol��1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1�������淴Ӧ�Ļ��Ϊ___kJ��mol��1
��3����CH4����ԭNOx�������������������Ⱦ�����磺
CH4��g��+4NO2��g��=4NO��g��+CO2��g��+2H2O��g�� ��H=��574kJ��mol��1
CH4��g��+4NO��g��=2N2��g��+CO2��g��+2H2O��g�� ��H=��1160kJ��mol��1
���ñ�״����4.48LCH4��ԭNO2����N2����Ӧ��ת�Ƶĵ�������Ϊ___���ð����ӵ�����NA��ʾ�����ų�������Ϊ___kJ��
���𰸡�C��s��+![]() O2��g��=CO2��g����H=��110.5 kJ��mol-1 409.0 1.6NA 173.4
O2��g��=CO2��g����H=��110.5 kJ��mol-1 409.0 1.6NA 173.4
��������
����֪��
C(s) ��O2(g)=CO2(g) ��H=��393.5kJ��mol��1
CO(g) ��![]() O2(g)=CO2(g) ��H=��283kJ��mol��1
O2(g)=CO2(g) ��H=��283kJ��mol��1
����������Ϣ������1������ʽ��ȥ��2������ʽ���ó�Cת��ΪCO���Ȼ�ѧ����ʽ
C(s) ��![]() O2(g) = CO(g) ��H=��110.5 kJ��mol-1���ʴ�ΪC(s) ��
O2(g) = CO(g) ��H=��110.5 kJ��mol-1���ʴ�ΪC(s) ��![]() O2(g) = CO(g) ��H=��110.5 kJ��mol-1��
O2(g) = CO(g) ��H=��110.5 kJ��mol-1��
����֪�Ȼ�ѧ����ʽ��H2(g)+![]() O2(g)=H2O(g) ��H=��241.8 kJ��mol��1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1����H=����Ӧ��ܣ��������ܣ���������=����Ӧ��ܣ���H=167.2 kJ��mol-1��(��241.8 kJ��mol��1)= 409.0 kJ��mol��1���������ܼ�Ϊ�淴Ӧ�Ļ�ܣ��ʴ�Ϊ409.0��
O2(g)=H2O(g) ��H=��241.8 kJ��mol��1���÷�Ӧ�Ļ��Ϊ167.2 kJ��mol-1����H=����Ӧ��ܣ��������ܣ���������=����Ӧ��ܣ���H=167.2 kJ��mol-1��(��241.8 kJ��mol��1)= 409.0 kJ��mol��1���������ܼ�Ϊ�淴Ӧ�Ļ�ܣ��ʴ�Ϊ409.0��
����CH4����ԭNOx�������������������Ⱦ�����磺
CH4(g) ��4NO2(g)=4NO(g) ��CO2(g) ��2H2O(g) ��H=��574kJ��mol��1
CH4(g) ��4NO(g)=2N2(g) ��CO2(g) ��2H2O(g) ��H=��1160kJ��mol��1
����������ʽ����ٳ���2���õ�
CH4(g)+2NO2(g)= N2(g) +CO2(g)+2H2O(g) ��H=��867kJ��mol��1��
�÷�Ӧ�м����̼�ӣ�4�����ߵ���4������ת��Ϊ8 mol�����������ĵ��ӣ�4�ӽ��͵�0�۵ĵ�����2 mol NO2��ת��8mol���ӣ����б�״����4.48 L CH4�������ʵ���Ϊ![]() ����Ӧ��ת�Ƶĵ������ʵ���Ϊ0.2 mol�� 8=1.6mol��������ĿΪ1.6NA��
����Ӧ��ת�Ƶĵ������ʵ���Ϊ0.2 mol�� 8=1.6mol��������ĿΪ1.6NA��
�ų�������Q=867kJ��mol��1��0.2 mol=173.4kJ���ʴ�Ϊ1.6NA��173.4kJ��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼʵ��װ��������֤ijЩ���ʵ����������Թ�A��װ�������Ĺ���NaHCO3���Իش��������⣺

��1����A�Թ��ڷ�����Ӧ�Ļ�ѧ����ʽ��___________________��
��2��Bװ�õ�������_____________________��
��3����˫�������ڷ�����Ӧ�Ļ�ѧ����ʽΪ______________________��
��4��˫�������ڹ۲쵽��ʵ��������____________________________��
����ʵ������˵��____________________________��
��5������������ڵ�Na2O2����Na2O����˫�������ڹ۲쵽��ʵ��������_____________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β����NO�����ķ�ӦΪ��N2(g)��O2(g)![]() 2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯��������������ȷ���ǣ� ��
2NO(g)��һ�������£������ʵ�����N2(g)��O2(g)�ں����ܱ������з�Ӧ����ͼ����a��ʾ�÷�Ӧ���¶�T��N2��Ũ����ʱ��ı仯������b��ʾ�÷�Ӧ��ijһ��ʼ��Ӧ�����ı�ʱN2��Ũ����ʱ��ı仯��������������ȷ���ǣ� ��
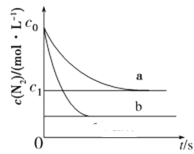
A.�¶�T�£��÷�Ӧ��ƽ�ⳣ��![]()
B.�¶�T�£����ŷ�Ӧ�Ľ��У����������ܶȲ���
C.����b��Ӧ�������ı����������ѹǿ
D.������b��Ӧ�������ı����¶ȣ����жϸ÷�Ӧ����H>0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1����һƿ��ɫ������Һ�����п��ܺ�H+��Na+��Mg2+��NH4+��Ba2+��Cl��SO42-��CO32-���ӡ��ֽ�������ʵ�飺
A.��pH��ֽ������Һ��������Һ��ǿ���ԣ�
B.ȡ������Һ��μ���ŨNaOH��Һ��ʹ��Һ�����Ա�Ϊ���ԣ�������������������ʹʪ��ĺ�ɫʯ����ֽ���������壻
C.ȡ����B�еļ�����Һ���μ�Na2CO3��Һ���а�ɫ����������
�ٸ���������ʵȷ��������Һ�п϶����ڵ�������__���϶������ڵ�������__��
��д��B�з�����Ӧ�����ӷ���ʽ__��
��2��ij��ѧѧϰС��ģ���°��Ƽ��ȡNa2CO3�Ĺ������£�
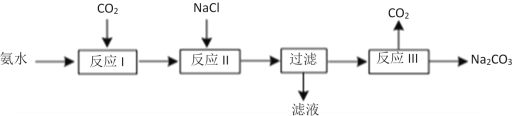
��֪��a.��Ӧ��Ļ�ѧ����ʽΪ��NH3��H2O��CO2=NH4HCO3
b.��Һ��NH4Cl������
�ٷ�Ӧ��Ϊ���ֽⷴӦ��д���÷�Ӧ�Ļ�ѧ����ʽ___��
����֤��Һ�к�Cl-���ӵ�ʵ�鷽��������Ϊ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ú̿��ȼ����Ϊ393.15kJ��mol��1��������ȼ����Ϊ242kJ��mol��1��һ����̼��ȼ����Ϊ283 kJ��mol��1��ijͬѧ���������ȵ�ú̿��������ˮ��ú¯�л��������ɫ���棬ú̿ȼ�յø�������˸�ͬѧ�ó����ۣ�ú̿ȼ��ʱ������ˮ����ʹú̿��ȼ��ʱ�ų�����������������й�˵����ȷ���ǣ� ��
A.��ʾ����ȼ���ȵ��Ȼ�ѧ����ʽΪ2H2(g)��O2(g)=2H2O(g) ��H����484 kJ��mol��1
B.��ʾCOȼ���ȵ��Ȼ�ѧ����ʽΪ2CO(g)��O2(g)=2CO2(g) ��H����283 kJ��mol��1
C.��ú̿ȼ�յø���������Ϊ��������̼ת�����˿�ȼ������
D.��242kJ��mol��1��283kJ��mol��1>393.15kJ��mol��1���ʸ�ͬѧ�Ľ����ǶԵ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ������CO2����ͨ��2Lδ֪Ũ�ȵ�NaOH��Һ�У���������Һ����μ���ϡ������������������Һ���ȣ�������������HCl�����ʵ����Ĺ�ϵ��ͼ��ʾ������������ܽ��HCl�Ļӷ�������˵����ȷ�ǣ�������
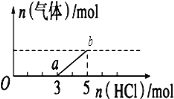
A.oa�η�Ӧ�����ӷ���ʽΪ��H++OH-=H2O
B.O����Һ���������ʵĻ�ѧʽΪNaHCO3��Na2CO3
C.��״���£�ͨ��CO2�����Ϊ4.48L
D.ԭNaOH��Һ�����ʵ���Ũ��Ϊ2.5molL��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ɶ���һ�ּ���ʳƷ�������з����һ����C��H��O����Ԫ����ɵ��л���A��Ϊȷ����ṹ�������¸�ʵ�飺
��6.0g�л���A��һ����������ȫ�ֽ���ֻ����3.36L����״����һ����̼��XgH2O��
��A�������ڱ�״���µ��ܶ�Ϊ5.357g/L
���к�0.24g�л���A������0.20mol/L������������Һ20.00mL��0.01mol����A��ȫת��Ϊ�������Ҵ�0.92g��0.01mol����A���������Ʒ�Ӧ�ų�0.336L��״���µ���������ȷ����
��1������ˮ������Ϊ____g��
��2��A��ʽ��___��A�Ļ�ѧʽ_____��
��3�����Ʋ�A�Ľṹ��ʽ��______
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧ�����ǵ�����������أ���ش�
��1����������Ҫע����ʳƽ�⣬����������_______������ţ���ͬ��ʳ���������______ʳ������� �ڼ���
��2�������ֳ���ҩ��ٰ�˾ƥ�֡�����ù�ء���θ��ƽ������Ƽ ijͬѧθ����࣬Ӧ�÷���______������ţ���ͬ��������ҩ��ȫ�Ƕȿ��ǣ�ʹ��ǰҪ����Ƥ�������Բ��Ե���_____�����ھ����˷����ã����ʰ�ί���Ͻ��˶�Ա���õ���_________��
��3��ƻ��֭������ϲ������Ʒ���������к���Fe2+����ե��ƻ��֭�ڿ����л���dz��ɫ��Ϊ�ػ�ɫ����ե֭ʱ����ά����C������Ч��ֹ��������������˵��ά����C����________������ţ����������� �ڻ�ԭ�� �ۼ��� ������
��4��ʳ��ֲ���ͽ����������ø��������ˮ��Ϊ��֬�����_________��д���ƣ��������������ɶ�����̼��ˮ���ṩ����������Ϊ�ϳ����������������ʵ�ԭ�ϣ�
��5��������������������ȱ����ƶѪ��ijƶѪ����ÿ���벹��1.4g��Ԫ�أ�����õ�ҩ���к�������������������Ϊ_________g��
��6������������ɵ����ʵĻ����ṹ��Ԫ���������һ�����еĹ������ǰ�������NH2����____��д�ṹ��ʽ�����ƣ��������й��ж�ʮ���ְ����ᣬ������������________�����������������������ϳɵİ������Ϊ������谱���
��7�������ڵ���ø������������ˮ��Ϊ�����ǣ�C6H12O6�������������������ڱ��������ɶ�����̼��ˮ��д�������������ڱ������Ļ�ѧ����ʽ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ�����ӵ�����������˵������ȷ���ǣ� ��
A.54g H2O�к���3NA����ԭ��
B.1mol Na2SO4����ˮ�У�������Һ��Na+����ΪNA
C.��״���£�NA��H2O������ռ�����ԼΪ22.4L
D.1mol CO2��NO2�Ļ�����к�����ԭ����Ϊ2NA
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com