
【题目】已知煤炭的燃烧热为393.15kJ·mol-1,氢气的燃烧热为242kJ·mol-1,一氧化碳的燃烧热为283 kJ·mol-1。某同学发现在灼热的煤炭上洒少量水,煤炉中会产生淡蓝色火焰,煤炭燃烧得更旺,因此该同学得出结论:煤炭燃烧时加少量水,可使煤炭在燃烧时放出更多的热量。下列有关说法正确的是( )
A.表示氢气燃烧热的热化学方程式为2H2(g)+O2(g)=2H2O(g) ΔH=-484 kJ·mol-1
B.表示CO燃烧热的热化学方程式为2CO(g)+O2(g)=2CO2(g) ΔH=-283 kJ·mol-1
C.“煤炭燃烧得更旺”是因为少量固体碳转化成了可燃性气体
D.因242kJ·mol-1+283kJ·mol-1>393.15kJ·mol-1,故该同学的结论是对的
【答案】C
【解析】
A选项,氢气燃烧热的热化学方程式为H2(g)+![]() O2(g)= H2O(l) ΔH=-242kJ·mol-1,应该是生成H2O(l),故A错误;
O2(g)= H2O(l) ΔH=-242kJ·mol-1,应该是生成H2O(l),故A错误;
B选项,CO燃烧热的热化学方程式为CO(g)+![]() O2(g)= CO2(g) ΔH=-283 kJ·mol-1,故B错误;
O2(g)= CO2(g) ΔH=-283 kJ·mol-1,故B错误;
C选项,“煤炭燃烧得更旺”是因为少量固体碳转化成了可燃性气体,燃烧会更旺,故C正确;
D选项,在煤炭和水反应时是一个吸热反应,先吸收了一定的热量,再是氢气和一氧化碳燃烧反应放出的热量242kJ·mol-1+283kJ·mol-1,实际上把吸收的热量减去,总共放出的热量依然是393.15kJ·mol-1,故D错误;
综上所述,答案为C。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】现有200 mL MgCl2和AlCl3混合溶液,其中Mg2+浓度0.2mol/L、 Cl-浓度为1.3 mol/L。要使Mg2+转化成Mg(OH)2并使Mg2+、Al3+分离开来,至少需要4 mol/L NaOH溶液( )
A. 80mLB. 100mLC. 120mLD. 140mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在2L恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1,反应前CO物质的量为10mol,2min达到平衡后CO物质的量为8mol。下列说法正确的是( )
A.升高温度,H2S浓度增加,表明该反应是吸热反应
B.通入CO后,正反应速率逐渐增大
C.反应前H2S物质的量为7mol
D.CO的平均反应速率为0.5mol/(L·s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)![]() 2NO2(g),随温度升高,混合气体的颜色变深。
2NO2(g),随温度升高,混合气体的颜色变深。
回答下列问题:
(1)反应的ΔH__0(填“大于”或“小于”);100℃时,体系中各物质浓度随时间变化如图所示。在0~60s时段,反应速率v(N2O4)为___mol/(L·s);反应的平衡常数K1为_____。

(2)100℃时达到平衡后,改变反应温度为T,N2O4以平均速率0.002 0mol/(L·s)降低,经10s又达到平衡。
①T___100℃(填“大于”或“小于”)
②计算温度T时反应的平衡常数K2为_____。
(3)温度T时反应达平衡后,将反应容器的容积增大一倍。平衡向___(填“正反应”或“逆反应”)方向移动,判断理由是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 甲烷的标准燃烧热为-890.3 kJ·mol-1,则甲烷燃烧的热化学方程式为CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa下,将0.5 mol N2和1.5 mol H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 常温下,反应C(s)+CO2(g)===2CO(g)不能自发进行,则该反应的ΔH>0
D. 同温同压下,H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:
C(s)+O2(g)=CO2(g) ΔH=﹣393.5kJ·mol-1
CO(g)+![]() O2(g)=CO2(g)ΔH=﹣283kJ·mol-1
O2(g)=CO2(g)ΔH=﹣283kJ·mol-1
根据上述信息,写出C转化为CO的热化学方程式___。
(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=﹣241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为___kJ·mol-1
O2(g)=H2O(g) ΔH=﹣241.8 kJ·mol-1,该反应的活化能为167.2 kJ·mol-1,则其逆反应的活化能为___kJ·mol-1
(3)用CH4催化还原NOx可以消除氮氧化物的污染。例如:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) ΔH=﹣574kJ·mol-1
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) ΔH=﹣1160kJ·mol-1
若用标准状况下4.48LCH4还原NO2生成N2,反应中转移的电子总数为___(用阿伏加德罗常数NA表示),放出的热量为___kJ。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】培哚普利主要用于治疗高血压与充血性心力衰竭,其合成路线如下:
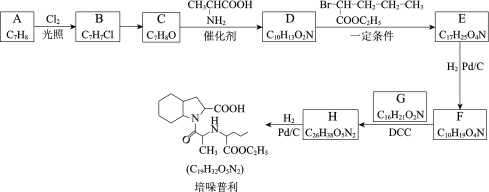
已知:ⅰ. ![]()
ⅱ.DCC是一种很强的脱水剂。
(1)芳香烃A的名称是___________________。
(2)B→C所需的试剂及条件是________________。
(3)C→D的化学方程式是____________________。
(4)D→E的反应类型是______________________。
(5)F的结构简式是____________________________。
(6)K存在互变异构体K′,G可由如下路线合成:

①X含有五元环和碳碳双键,其结构简式是______。
②上述合成培哚普利的路线中,将Y转化为G,再与F反应,而不直接用Y的主要目的是______,与合成路线中______________填字母)的转化目的相同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】香兰素是重要的香料之一,它可由丁香酚经多步反应合成。
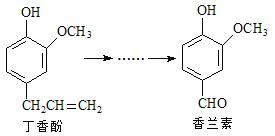
有关上述两种化合物的说法正确的是
A. 常温下,1mol丁香酚只能与1molBr2反应
B. 丁香酚不能使FeCl3溶液发生显色反应
C. 1mol香兰素最多能与3mol氢气发生加成反应
D. 香兰素分子中至少有12个原子共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】地球上的氮元素对动植物有重要作用,其中氨的合成与应用是当前的研究热点。
(1)不同温度下工业合成氨N2(g)+3H2(g)![]() 2NH3(g)反应的部分K值如下表。
2NH3(g)反应的部分K值如下表。
温度/℃ | 25 | 400 | 450 |
K | 5×108 | 0.507 | 0.152 |
①工业合成氨反应平衡常数表达式为K=___。
②请结合平衡常数解释,该反应为放热反应的理由___。
③从平衡视角考虑,工业固氮应该选择常温条件,但实际工业生产却选择500℃左右的高温,解释其原因___。
(2)科学家利用电解法在常温常压下实现合成氨,工作时阴极区的微观示意图如图,其中电解液为溶解有三氟甲磺酸锂和乙醇的惰性有机溶剂。
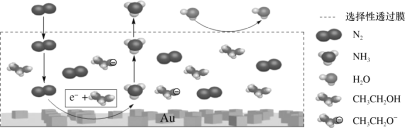
①阴极区生成NH3的电极方程式为___。
②下列说法不正确的是___(填字母序号)。
a.三氟甲磺酸锂的作用是增强导电性
b.该装置用金(Au)作催化剂目的是降低N2的键能
c.选择性透过膜可允许N2和NH3通过,防止H2O进入装置
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com