
【题目】下列物质的俗名与其化学式、用途都相符的是( )
A.烧碱、Na2CO3、制玻璃 B.小苏打、NaHCO3、治疗胃酸过多
C.苏打、NaOH、造纸 D.食盐、NaCl、化肥
 七星图书口算速算天天练系列答案
七星图书口算速算天天练系列答案 初中学业考试导与练系列答案
初中学业考试导与练系列答案科目:高中化学 来源: 题型:
【题目】在xR2++yH++O2=4R3++nH2O的离子方程式中,下列判断正确的是 ( )
A. y=4,R2+是氧化剂 B. y=2,R2+是还原剂
C. y=2,R3+是还原产物 D. y=4,R3+是氧化产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,将少量水加入下列物质中,相关量变化正确的是
A. AgCl悬浊液中 c(Cl-)变小 B. 0.1mol/LCH3COOH溶液中 c(H+)变小
C. 0.1mol/LNa2CO3c(HCO3-)变大 D. 0.1mol/LNH4Cl溶液中 n(OH-)变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列装置有关说法错误的是

A. 装置Ⅰ:可以用来验证碳的非金属性比硅强
B. 装置Ⅱ:可以用来比较Na2CO3和NaHCO3的热稳定性
C. 装置Ⅲ:先从①口进气收集满二氧化碳,再从②口进气,可收集NO气体
D. 装置Ⅳ:制备Fe(OH)2并能保证较长时间观察到白色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】针对下面10种元素,完成以下各小题。
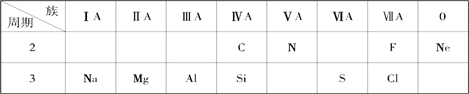
(1)金属性最强的元素是________(填名称);化学性质最不活泼的元素是________(填元素符号)。
(2)S 原子结构示意图为___________;
(3)除Ne以外的其余九种元素的原子中,原子半径最小的是___________(填元素符号);
(4)元素硅的氧化物常用于制造___________(填一种高性能的现代通讯材料的名称);
(5)氮元素的最高价氧化物对应水化物与其氢化物能生成盐M,M中含有的化学键类型为_______________;氮元素的氢化物与氯元素的氢化物能生成盐W,W的电子式为____________________。
(6)元素最高价氧化物对应的水化物中,碱性最强的是_______(填化学式),呈两性的是_________(填化学式);两者反应的化学方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关甲烷的说法中,不正确的是
A. 1mol甲烷中含有4mol C—H共价健
B. CH4、CCl4和CH3Cl都是正四面体结构
C. 光照条件下甲烷能与溴蒸气发生取代反应
D. 通常情况下,甲烷跟强酸、强碱、强氧化剂不反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。

(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com