
【题目】氮、磷、砷是同族元素,该族元素单质及其化合物在农药、化肥等方面有重要应用。请回答下列问题。
(1)氮与元素周期表同周期的相邻元素的第一电离能由小到大的顺序为_____________
(2)与阴离子(CN-)互为等电子体的两种分子有______________、____________________
(3)氨水溶液中存在多种氢键,任表示出其中两种_________________、_________________.
(4)H3PO4的K1、K2、K3分别为7.6×10-3、6.3×10-8、4.4×10-13。硝酸完全电离,而亚硝酸K=5.1×10-4,请根据结构与性质的关系解释:
①H3PO4的K1远大于K2的原因是______________
②硝酸比亚硝酸酸性强的原因是______________

(5)X+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示。X的核外电子排布式为_________________与同一个N3-相连的X+有_____ 个。
(6)X的高价阳离子(X2+)在水溶液中存在离子[X(H2O)4]2+,则X2+与H2O之间的键型为________________该化学键能形成的原因是___________________请画出[X(H2O)4]2+离子的结构式(用元素符号写结构式)__________________。
【答案】 C<O<N N2 CO O-H…N N-H…O(其他正确形式也给分) 第一步电离生成的负离子较难再进一步电离出带正电荷的H+ 硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强 ls22s22p63s23p63d104sl 6 配位键 H2O能提供孤对电子,Cu2+能接受孤对电子(或Cu2+有空轨道) 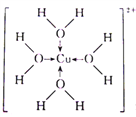
【解析】本题考查配合物的成键情况、电离能、氢键、电子排布式等知识,题目难度中等,注意掌握电离能大小比较方法及配合物的成键情况,明确氢键、电子排布式的表示方法,试题知识点较多、综合性较强,充分考查学生的分析、理解能力及灵活应用能力。
(1)C、N、O元素是同一周期相邻元素,同一周期元素自左而右第一电离能呈增大趋势,但N元素原子2p能级是半充满稳定状态,能量较低,第一电离能高于同周期相邻元素,则第一电离能由小到大的顺序为C<O<N。
(2)根据等电子体的定义,将CN-中C原子及1个负电荷换成1个N原子,可得等电子体N2,将N原子及1个负电荷换成1个O原子,可得等电子体CO。
(3)N元素与O元素的电负性都很强,不同分子中的N原子、O原子与H原子之间都可以形成氢键,如O-H…N、N-H…O、O-H…O、N-H…N。
(4)①磷酸第一步电离出氢离子后变为阴离子,阴离子难电离出带正电荷的氢离子,所以H3PO4的K1远大于K2,则答案为第一步电离生成的负离子较难再进一步电离出带正电荷的H+;②由于硝酸中非羟基氧是两个,亚硝酸非羟基O是一个,非羟基氧越多酸性越强,所以硝酸比亚硝酸酸性强。
(5)X+中所有电子正好充满K、L、M三个电子层,X原子核外电子数=2+8+18+1=29,则X为Cu元素,Cu元素是29号元素,原子核外电子数为29,核外电子排布式为ls22s22p63s23p63d104sl ;该晶胞中白色小球=8×1/8=1,黑色小球=12×1/4=3,N3-带3个单位负电荷、Cu+带1个单位正电荷,所以形成的化合物为Cu3N,则白色小球表示N3-、黑色小球表示Cu+,则同一个N3-相连的Cu+有6个。
(6)Cu2+有空轨道,能接受孤对电子,H2O能提供孤对电子,所以Cu2+与H2O之间的化学键类型为配位键,原因为H2O能提供孤对电子,Cu2+能接受孤对电子(或Cu2+有空轨道);[X(H2O)4]2+离子为[Cu(H2O)4]2+,[Cu(H2O)4]2+离子中含有配位键,其结构式为: 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列物质的俗名与其化学式、用途都相符的是( )
A.烧碱、Na2CO3、制玻璃 B.小苏打、NaHCO3、治疗胃酸过多
C.苏打、NaOH、造纸 D.食盐、NaCl、化肥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对氨基苯甲酸酯类是一类局部麻醉药,化合物M是该类药物之一。合成M的一种路线如下:

已知以下信息:
①核磁共振氢谱显示B只有一种化学环境的氢,H苯环上有两种化学环境的氢。
② 。
。
③E为芳香烃,其相对分子质量为92。
④![]() (苯胺,易被氧化)。
(苯胺,易被氧化)。
回答下列问题:
(1)A的结构简式为_________________,其化学名称是_____________________。
(2)由E生成F的化学方程式为_________________________________________。
(3)由G生成H的反应类型为__________________,H在一定条件下可以发生聚合反应,写出该聚合反应的化学方程式__________________________________________________。
(4)M的结构简式为________________________________。
(5)D的同分异构体中不能与金属钠反应生成氢气的共有_________种(不考虑立体异构),其中核磁共振氢谱只有两组峰,且峰面积比为6:1的是_________________(写结构简式)。
(6)参照上述合成路线,以乙烯和环氧乙烷为原料(无机试剂任选)制备1,6-己二醛,设计合成路线 ___________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关如下反应的叙述正确的是
I :C(g)+H2O(g) ![]() CO(g)+H2(g) △H=+131.0kJ/mol
CO(g)+H2(g) △H=+131.0kJ/mol
II: CO(g) +H2O(g) ![]() CO2(g) + H2(g) △H=-43kJ/mol
CO2(g) + H2(g) △H=-43kJ/mol
III: CaO(s) + CO2(g)![]() CaCO3(s) △H =-178.3 kJ/mol
CaCO3(s) △H =-178.3 kJ/mol
IV: C(s)+2H2O(g)+CaO(s) ![]() CaCO3(s)+2H2(g) △H=akJ/mol
CaCO3(s)+2H2(g) △H=akJ/mol
A. a=+90.3
B. 恒温恒压下,在己达平衡的反应I体系中再充入少量He时平衡正向移动
C. 其他条件不变,加压对反应Ⅱ的反应速率无影响
D. 其他条件不变,升高温度可提高反应Ⅲ中CO2的转化率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酯F是一种广泛用于香精的调香剂,其合成路线如下图所示:

已知:A的核磁共振氢谱有4组吸收峰,峰面积之比为3:3:2:2,E存在顺反异构,且既能与纯碱溶液反应又能使溴的CCl4溶液褪色。
(1)A的分子式为________。反应①、④的反应类型分别为_________、_______________。
(2)E所含官能团的名称:____________。
(3)写出下列反应的化学方程式:
反应⑤:______________________。
反应⑥:______________________。
(4)H的同分异构体有多种,属于芳香族化合物的(不含H)共______________种;
写出其中一种的结构简式:_______________________。
(5)M是G的同系物,比G的相对分子质量大14。请以M为原料(其他原料任选)
合成有机物:N: 。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)
。________________(在方框内写中间体的结构简式,在“→”上方或下方写反应所需条件或试剂)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于某酸的酸式盐NaHY的水溶液的下列叙述中,正确的是
A. 该酸式盐的水溶液一定显酸性
B. 在该盐溶液中,离子浓度为:c(Na+)>c(Y2-)>c(HY-)>c(OH-)>c(H+)
C. 若HY-能水解,水解方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
D. 若HY-能电离,电离方程式为:HY-+H2O![]() Y2-+H3O+
Y2-+H3O+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人们在远距离运输果实或花朵时,在装有果实或花朵的密闭容器中,常放有浸泡过KMnO4酸性溶液的硅土,其作用是( )
A. 给容器消毒B. 杀死果实周围的细菌,防止霉变
C. 延长果实或花朵的寿命D. 催熟果实或花朵
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com