
����Ŀ����ѧʵ���Ҳ����ķ�Һ�к��д�������Ⱦ���������ʣ�Ϊ�˱�����������ѧʵ���Ҳ����ķ�Һ���뾭����������ŷš�ij��ѧʵ���Ҳ��������Է�Һ�к���Fe3+��Cu2+��Ba2+���ֽ��������Ӻ�Cl-һ�������ӣ�ʵ������������������Է�Һ���д������Ի��ս������ⶨ����������������

��֪ʵ���д��������Է�Һ�����Ϊ1L����pH�Ʋⶨ������H+���ʵ���Ũ��Ϊ0.10mol/L��
��ش��������⣺
(1)ʵ���в���I��II��III�ķ�����ͬ��������������Ϊ���ˡ�_________�����
(2)������������������Һ��ɫΪ�ػ�ɫ���÷�Ӧ�����ӷ���ʽΪ��__________��
(3)ʵ���г�������I ������Ϊ4.66g������II ������Ϊ15.2g����������ϡ�����ܽ����II ������˱�״���µ���ɫ����4.48L�������II �н���ͭ������Ϊ________g��
(4)ʵ���н�����III���г�����գ�ʹ���������˾ƾ��ơ����żܡ������ǡ��������⣬����_____�������ƣ������õ��ĺ���ɫ��������Ϊ40.0g����ԭ��Һ�������ӵ����ʵ���Ũ��Ϊ________��д��������̣���
���𰸡�ϴ��2Fe2++H2O2+2H+= 2Fe3++2H2O9.6����1.04mol/L
���������ں���Fe3+��Cu2+��Ba2+��Cl-�����Է�Һ�еμӹ���Na2SO4��Һ��ͨ������I�Ĺ��ˡ�ϴ�Ӳ�����ɵ�BaSO4��������Һ�м������Fe�ۿɻ�ԭ��Һ�е�Cu2+��ͨ���������Ĺ��ˡ�ϴ�Ӳ�����ɵ�Fe��Cu�Ļ�����������Һ�� �μӹ�����H2O2��Һ���ɽ���Һ�е�Fe2+����ΪFe3+���μӹ���NaOH��Һ�ɵ�Fe(OH)3���������������Ĺ��ˡ�ϴ�Ӳ�����ɵ�Fe(OH)3��������Һ���ŷţ�
(1)�з�����֪ʵ���в���I��II��III�ķ�����ͬ��������������Ϊ���ˡ�ϴ�ӡ����
(2)H2O2����Һ�е�Fe2+����ΪFe3+��������Ӧ�����ӷ���ʽΪ2Fe2++H2O2+2H+= 2Fe3++2H2O��
(3)����I BaSO4����������Ϊ4.66g�����ʵ���Ϊ0.02mol������II Fe��Cu�Ļ���������Ϊ15.2g����������ϡ�����ܽ����II �������״���µ���ɫ����NOΪ4.48L�������ʵ���Ϊ0.2mol����Cu�����ʵ���Ϊxmol��Fe�����ʵ���Ϊymol����64x+56y=15.2��2x+3y=0.2��3�������غ�ʽ������ã�x=0.15��y=0.1��Cu������Ϊ64g/mol��0.15mol=9.6g��
(4)����������Ҫ�������н��У���ʵ���н�����III���г�����գ�ʹ���������˾ƾ��ơ����żܡ������ǡ��������⣬�������������õ��ĺ���ɫ����Fe2O3������Ϊ40.0g�������ʵ���Ϊ40.0g��160g/mol=0.25mol������Һ3�к��е�Fe2+Ϊ0.5mol��ԭ������Һ�к���H+�����ʵ���Ϊ0.10mol/L��1L=0.1mol�����ܽ�Fe���ɵ�Fe2+Ϊ0.1mol��![]() =0.05mol��ԭ������Һ�е�Cu2+�����ʵ���Ϊ0.15mol�����ܽ�Fe���ɵ�Fe2+Ϊ0.15mol������2Fe3++Fe=3Fe2+��ԭ��Һ�е�Fe3+�����ʵ���Ϊ(0.5mol-0.05mol-0.15mol)
=0.05mol��ԭ������Һ�е�Cu2+�����ʵ���Ϊ0.15mol�����ܽ�Fe���ɵ�Fe2+Ϊ0.15mol������2Fe3++Fe=3Fe2+��ԭ��Һ�е�Fe3+�����ʵ���Ϊ(0.5mol-0.05mol-0.15mol)![]() =0.2mol������ԭ������Һ�к���Ba2+��0.02mol��������Һ�ǵ����ԵĿ�֪n(Cl-)=n(Ba2+)��2+n(H+)+n(Fe3+)��3+n(Cu2+)��2=0.02mol��2+0.1mol+0.2mol��3+0.15mol��2=1.04mol����ԭ��Һ�������ӵ����ʵ���Ũ��Ϊ
=0.2mol������ԭ������Һ�к���Ba2+��0.02mol��������Һ�ǵ����ԵĿ�֪n(Cl-)=n(Ba2+)��2+n(H+)+n(Fe3+)��3+n(Cu2+)��2=0.02mol��2+0.1mol+0.2mol��3+0.15mol��2=1.04mol����ԭ��Һ�������ӵ����ʵ���Ũ��Ϊ![]() =1.04mol/L��
=1.04mol/L��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����״���£������ݻ���ȵ�����ƿ��һ��װ��O2����һ��װ��CH4����ƿ���������ͬ�ģ� ��
A������ B��ԭ������ C���ܶ� D��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���Ƚ�1 mol N2��1 mol CO������������:������ ���������� ��ԭ�����������,����һ����ͬ����( )
A���� B���٢� C���٢ڢ� D���ڢ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����(NA��ʾ�����ӵ�������ֵ) �� ��
A. �ڳ��¡���ѹ�£�11.2 L N2���еķ�������0.5NA
B. ��״���£�22.4 Lˮ����ˮ������Լ��NA
C. 32 g O2�ڱ�״���µ����Լ��22.4 L
D. 1 mol��L-1FeCl3��Һ������Cl������ĿΪ3NA
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ڷ�װ���ϵ�˵���������
A. ���ַ�֯��ά����Ҫ�ɷֶ��Ǹ߷��ӻ�����
B. �����ϵ���˿����������˿������Ҫ�ɷ�����ά��
C. ����ȼ�յķ���������ëΧ���ͺϳ���άΧ��
D. ����������Ȼ��ά
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����˺��ʳ��ˮ�Ժ��п����Ե�CaCl2��MgCl2��Na2SO4 �����ʣ�ͨ�����¼���ʵ�鲽�裬���Ƶô�����ʳ��ˮ���� �����Թ�����Na2CO3��Һ���� �����Թ�����NaOH��Һ���� �����Թ�����BaCl2 ��Һ��������ϡ�����������ݲ������� ���ˡ���ȷ�IJ���˳���� �� ��
A���ۢڢ٢ݢ� B���٢ڢۢݢ� C���ڢۢ٢ܢ� D���ۢݢڢ٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʵ���Ũ����ȡ��Ҷ���һ��������A����B����һ��������X����Y����ɵ���
��Һ���ݲⶨ������AX��BY��Һ��pH��7��AY��Һ��pH��7��BX��Һ��pH��7���ɴ��жϲ�ˮ��������� ��
A��BX B��AX C��AY D��BY
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 �������£�������Һ�е�����Ũ�ȹ�ϵ��ȷ����( )
A��Ũ����ͬ�Ģ�CH3COONa��Һ����NaClO��Һ����NaCl��Һ�е�c(H��)����>��>��
B��NaHC2O4��Һ�У�c(H��)��c(Na��)��c(OH��)��c(C2O![]() )��c(HC2O
)��c(HC2O![]() )
)
C��NaOH��Һ��NH4Cl��Һ�������Һ�����ԣ����Ϻ����Һ�У�c(Cl��)��c(NH![]() )��c(Na��)
)��c(Na��)
D��pH��6��NaHSO3��Һ�У�c(SO![]() )��c(H2SO3)��9.9��10��6 mol��L��1
)��c(H2SO3)��9.9��10��6 mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ˮ�Ǽ����ĵ���ʣ��ı��¶Ȼ����ijЩ����ʻ�Ӱ��ˮ�ĵ��롣��ش��������⣺
(1)��ˮ��100 ��ʱ��pH��6�����¶���0.1 mol��L��1��NaOH��Һ��pH��________��
(2)25 ��ʱ����ˮ�м�������̼���ƹ��壬�õ�pHΪ11����Һ����ˮ������ӷ���ʽΪ_________________����ˮ�������c(OH��)��________ mol��L��1��
(3)�����Ϊ100 mL��pH��Ϊ2��������һԪ��HX����ˮϡ������pH����Һ����Ĺ�ϵ��ͼ��ʾ����HX��________(�ǿ�ᡱ�����ᡱ)��������______________________________��
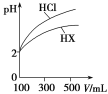
(4)����ƽ�ⳣ���Ǻ���������ʵ���̶�ǿ��������������֪��
��ѧʽ | ����ƽ�ⳣ��(25 ��) |
HCN | K��4.9��10��10 |
CH3COOH | K��1.8��10��5 |
H2CO3 | K1��4.3��10��7��K2��5.6��10��11 |
��25 ��ʱ����Ũ�ȵ�NaCN��Һ��Na2CO3��Һ��CH3COONa��Һ����Һ��pH�ɴ�С��˳��Ϊ________(�ѧʽ)��
��25 ��ʱ����0.5 mol��L��1��CH3COOH��Һ����CH3COOH�������c(H��)Լ����ˮ�������c(H��)��________����
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com