
【题目】甲、乙两烧瓶中各盛有100mL 3mol·L-1的盐酸和氢氧化钾溶液;向两烧瓶中分别加入等质量的铝粉,反应结束测得生成的气体体积甲∶乙=2∶3(相同状况),则加入铝粉的质量为( )
A. 2.7g B. 3.6g C. 5.04g D. 4.05g
【答案】D
【解析】试题分析:铝的质量相同,盐酸和氢氧化钠溶液中溶质的物质的量相同,若Al都完全反应,则生成氢气应相等,而应结束后测得生成的气体体积比为甲:乙=2:3,由方程式:2Al+6HCl═2AlCl3+3H2↑、2Al+2NaOH+2H2O═2NaAlO2+3H2↑,可知相同物质的量的Al反应时,消耗HCl较多,可知酸与金属反应时酸不过量,碱与金属反应时碱过量,
盐酸和氢氧化钠溶液中溶质的物质的量均为0.1L×3mol/L=0.3mol,
设铝与酸反应时酸完全反应,生成的氢气的物质的量为x,则:
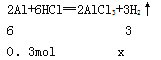
解得x==0.15mol,
则碱与金属铝反应生成的氢气的物质的量为0.15mol×![]() =0.225mol,
=0.225mol,
碱与金属铝反应时铝完全反应,设与碱反应的铝的物质的量为y,则:
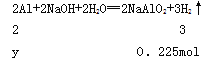
解得y==0.15mol,
则铝的质量为0.15mol×27g/mol=4.05g,故D正确。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】随原子序数的递增,八种短周期元素(用字母表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。根据判断出的元素回答问题:
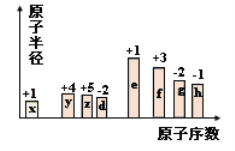
(1)f在元素周期表的位置是_______。
(2)上述元素形成的简单阴、阳离子中,离子半径最大的是(用化学式表示,下同)_______________;在e、f、g、h四种元素的最高价氧化物对应的水化物中的酸性最强的是___________________。
(3)d、e能形成原子个数比为1:1的化合物,该化合物的电子式为________________,0.1 mol该化合物与足量水反应时转移的电子数为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼氢化物NaBH4(B元素的化合价为+3价)燃料电池(DBFC), 由于具有效率高、产物清洁无污染和燃料易于储存和运输等优点,被认为是一种很有发展潜力的燃料电池。其工作原理如下图所示,下列说法正确的是
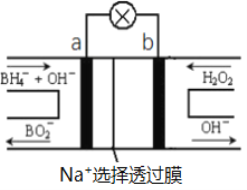
A. 电池的负极反应为BH4-+2H2O-8e-=BO2-+8H+
B. 放电时,每转移1mol电子,理论上有1molNa+透过选择透过膜
C. 电池放电时Na+从b极区移向a极区
D. 电极a发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2008年初我国南方遭遇的冰雪灾害中,使用了一种融雪剂,其主要成分的化学式为XY2,X、Y为周期表前20号元素,其阳离子和阴离子的电子层结构相同,且1 molXY2含有54 mol电子。
(1)该融雪剂的化学式是___;Y与氢元素形成的化合物的电子式是___。
(2)元素D、E原子的最外层电子数是其电子层数的2倍,D与Y相邻,则D的离子结构示意图是___;D与E能形成一种非极性分子,该分子的结构式为___;D所在族元素的氢化物中,沸点最低的是(填化学式)___。
(3)元素R与Y同主族,其氢化物能用于刻蚀玻璃,R2与NaOH溶液反应的产物之一是OR2,该反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】AlCl3易水解。某同学设计用下图的装置制备少量的AlCl3固体。下列说法错误的是
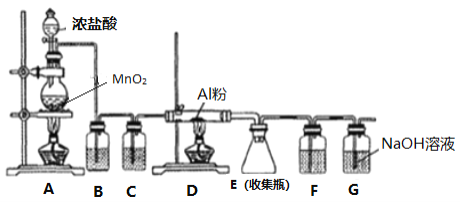
A. G装置作用是除去多余氯气,防止空气污染
B. 装置C和F中的试剂均为浓硫酸,其作用是防止水蒸气进人D和E中
C. B中试剂为饱和碳酸氢钠溶液
D. 实验过程中应先点燃A处的酒精灯,待装置中充满黄绿色气体时再点燃D处的酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】白藜芦醇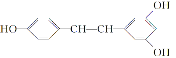 广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
广泛存在于食物(例如桑椹、花生,尤其是葡萄)中,它可能具有抗癌性。下列关于白藜芦醇的说法错误的是( )
A. 白藜芦醇属于三元醇,能与Na反应产生H2
B. 能与NaOH反应,1 mol 该化合物最多能消耗NaOH 3 mol
C. 能使FeCl3溶液显色
D. 能与浓溴水反应,1 mol 该化合物最多能消耗溴6 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出如图中序号①~④仪器的名称:
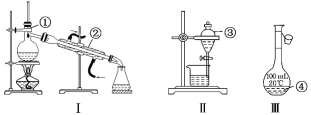
(1)①_____;②____;③_____;④_____。
(2)仪器①~④中,使用时必须检查是否漏水的有____(填仪器序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的铜片加入到20 mL某浓度的浓硝酸中,充分反应后,铜片全部溶解,并收集到标准状况下的混合气体共896mL(假设[体中只有NO和NO2)。向反应后所得溶液中逐滴滴加lmol/L的NaOH溶液,产生沉淀质量与加入NaOH溶液体积(单位: mL)的关系如图所示。回答下列问题:
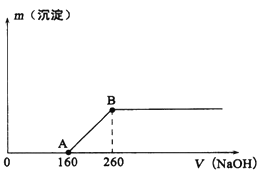
(1)B点所表示溶液中只含一种溶质,该物质是______(填化学式)。
(2)收集的气体中,NO2的物质的量为_______mol。
(3)原浓硝酸的浓度为_______mol/L。
(4)欲使铜与硝酸产生的混合气体在氢氧化钠溶液中全部转化为硝酸钠,至少需要30%的双氧水______g(保留两位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用含结晶水的碱式盐X(四种元素组成的纯净物)进行了如下实验:
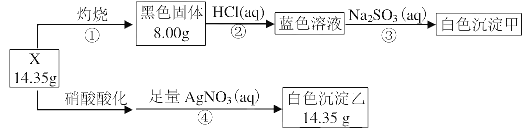
白色沉淀甲的组成元素与蓝色溶液的溶质相同,且组成的元素原子物质的量之比为1:1。请回答:
(1)X中含有的元素除了H、O之外,还含有的元素是___、____。
(2)白色沉淀甲的化学式是___,X的化学式是___。
(3)步骤③的离子方程式是___。
(4)在一定的温度下,将空气不断通入白色沉淀甲的悬浊液中可得到X,该反应的化学方程式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com