
【题目】下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.将1L0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12
D.pH=8的NaOH溶液稀释100倍,其pH=6
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用有机物甲可制备环己二烯(![]() ),其反应路线如图所示:
),其反应路线如图所示:
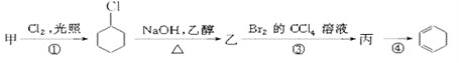
已知:RCH2CH2Br![]() RCH=CH2
RCH=CH2
下列有关判断正确的是( )
A.甲的化学名称是苯B.乙的结构简式为![]()
C.反应①为加成反应D.有机物丙既能发生加成反应,又能发生取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的产物中,有的有同分异构体,有的没有同分异构体,其中一定不存在同分异构体的反应是
A.异戊二烯(![]() )与等物质的量的Br2发生加成反应
)与等物质的量的Br2发生加成反应
B.2氯丁烷与NaOH乙醇溶液共热发生消去HCl分子的反应
C.甲苯在一定条件下发生硝化反应生成一硝基甲苯的反应
D.邻羟基苯甲酸与NaHCO3溶液反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲胺(CH3NH2)是一种应用广泛的一元弱碱,其电离方程式为:CH3NH2+H2O![]() CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
CH3NH3++OH-常温下,向20.0mL0.10mol/L的甲胺溶液中滴加VmL0.10mol/L的稀盐酸,混合溶液的pH与相关微粒浓度的关系如图所示。下列说法中错误的是( )
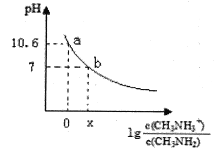
A. b点对应加入盐酸的体积V<20.00mL
B. 常温下,甲胺的电离常数为Kb,则Kb=10-3.4
C. b点可能存在关系:c(Cl-)>c(CH3NH3+)>c(H+)>cOH-)
D. V=20.00mL时,溶液中水电离的c(H+)>10-7mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
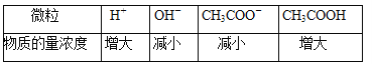
则X物质可能是( )
A.氯化氢B.氢氧化钠C.蒸馏水D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将盐酸溶液滴加到联氨(N2H4)的水溶液中,混合溶液中的微粒的物质的量分数![]() (X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是
(X)随-lgc(OH-)变化的关系如图所示。下列叙述错误的是![]()
![]()
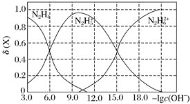
A.Kb1(N2H4)=10-6
B.反应![]() 的pK=9.0(已知:Pk=-lgK)
的pK=9.0(已知:Pk=-lgK)
C.N2H5Cl溶液中c(H+)>c(OH-)
D.N2H5Cl溶液中存在c(Cl-)+c(OH-)=c(N2H5+)+2c(N2H62+)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶电解质在水溶液中存在溶解平衡MmAn(s)![]() mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
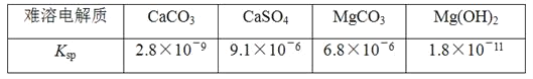
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__。
(3)设计第③步的目的是什么__。
(4)请补充第④步操作及发生的现象__。
(5)请写出该转化在实际生活、生产中的一个应用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,充分燃烧一定量的丁烷放出热量161.9kJ,经测定完全吸收生成的CO2需消耗5mol/L的KOH溶液100ml,恰好生成正盐,则此条件下热化学方程式:C4H10(g)+![]() O2(g)→4CO2(g)+5H2O(g)的△H为( )
O2(g)→4CO2(g)+5H2O(g)的△H为( )
A. +2590.4kJ/mol B. ﹣2590.4kJ/mol C. +1295.2kJ/mol D. ﹣1295.2kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)=CO2(g) △H1 CO2(g)+C(s)=2CO(g) △H2
2CO(g)+O2(g)=2CO2(g)△H3 4Fe(s)+3O3(g)=2Fe2O3(s)△H4
3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)△H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0B.△H1>△H2
C.△H1=△H2+△H3D.△H3=△H4+△H5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com