
【题目】向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
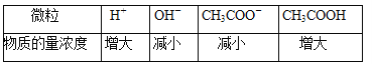
则X物质可能是( )
A.氯化氢B.氢氧化钠C.蒸馏水D.醋酸
【答案】A
【解析】
CH3COONa稀溶液中存在醋酸根离子的水解反应,CH3COO-+H2OCH3COOH+OH-;溶液呈碱性,依据溶液中的平衡和离子积常数判断离子浓度变化;图表中H+浓度、CH3COOH增大,OH-、CH3COO-减小,说明加入的物质应是酸性溶液,促进了CH3COONa溶液的水解,结合选项分析判断。
A.氯化氢,对CH3COONa水解平衡起促进作用,H+浓度、CH3COOH增大,OH-、CH3COO-减小,故A符合表格粒子浓度变化;
B.加氢氧化钠,抑制了CH3COONa溶液的水解,导致H+浓度、CH3COOH减小,OH、CH3COO增大,故B不符合表格粒子浓度变化;
C.越稀越水解,CH3COOH、OH、CH3COO浓度都减小,而H+浓度增大,故C不符合表格粒子浓度变化;
D.加醋酸,H+、CH3COO浓度都增大,故D不符合表格粒子浓度变化;


科目:高中化学 来源: 题型:
【题目】已知烃B分子内C、H原子个数比为1︰2,相对分子质量为28,核磁共振氢谱显示分子中只有一种化学环境的氢原子,且有如下的转化关系:
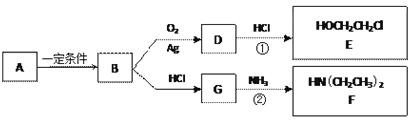
(1)B的结构简式是_________________
(2)A可能属于下列哪类物质___________
a.醇 b.卤代烃 c.酚 d.羧酸
(3)反应①是D与HCl按物质的量之比1︰1的加成反应,则D的分子式是___________。
反应②可表示为:G + NH3→ F + HCl (未配平),该反应配平后的化学方程式是(有机化合物均用结构简式表示): ____________________________________
化合物E(HOCH2CH2Cl)和 F [ HN(CH2CH3)2 ]是药品普鲁卡因合成的重要中间体,普鲁卡因的合成路线如下:(已知:![]() )
)

(4)甲的结构简式是 _________________。
由甲苯生成甲的反应类型是_________________。
(5)乙中有两种含氧官能团,反应③的化学方程式是___________________________________
(6)丙中官能团的名称是_______________________________________。
(7)普鲁卡因有两种水解产物丁和戊。
① 戊与甲互为同分异构体,戊的结构简式是_____________________。
② 戊经聚合反应制成的高分子纤维广泛用于通讯、宇航等领域。该聚合反应的化学方程式是__________________________________________。
③ D的红外光谱表明分子内除C—H键、C—C键外还含有两个C—O单键。则D与F在一定条件下反应生成丁的化学方程式是________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的电导率越大,导电能力越强。用0.100mol·L-1的KOH溶液分别滴定体积均为20.00mL、浓度均为0.100molL-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中溶液的电导率如图所示。下列说法正确的是( )
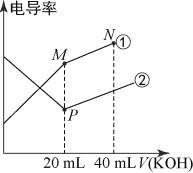
A. 曲线②代表滴定CH3COOH溶液的曲线
B. 在相同温度下,P点水电离程度大于M点
C. M点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.1mol·L-1
D. N点溶液中:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。
下列有关麦考酚酸说法正确的是( )
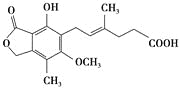
A.在一定条件下可与氢气发生加成反应,最多消耗氢气5 mol
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生氧化、还原、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[实验化学]
3,5-二甲氧基苯酚是重要的有机合成中间体,可用于天然物质白柠檬素的合成。一种以间苯三酚为原料的合成反应如下:

甲醇、乙醚和3,5-二甲氧基苯酚的部分物理性质见下表:
物质 | 沸点/℃ | 熔点/℃ | 密度(20℃) / g·cm-3 | 溶解性 |
甲醇 | 64. 7 |
| 0. 7915 | 易溶于水 |
乙醚 | 34. 5 |
| 0. 7138 | 微溶于水 |
3,5-二甲氧基苯酚 |
| 33 ~36 |
| 易溶于甲醇、乙醚,微溶于水 |
(1)反应结束后,先分离出甲醇,再加入乙醚进行萃取。①分离出甲醇的操作是的_________。
②萃取用到的分液漏斗使用前需_______并洗净,分液时有机层在分液漏斗的_____填(“上”或“下”)层。
(2)分离得到的有机层依次用饱和NaHCO3溶液、饱和食盐水、少量蒸馏水进行洗涤。用饱和NaHCO3溶液洗涤的目的是______________;用饱和食盐水洗涤的目的是______________。
(3)洗涤完成后,通过以下操作分离、提纯产物,正确的操作顺序是_____(填字母)。
a.蒸馏除去乙醚 b..重结晶 c.过滤除去干燥剂 d.加入无水CaCl2干燥
(4)固液分离常采用减压过滤。为了防止倒吸,减压过滤完成后应先_______,再______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列液体均处于25℃,有关叙述正确的是( )
A.某物质的溶液pH<7,则该物质一定是酸或强酸弱碱盐
B.pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍
C.将1L0.1mol·L-1的Ba(OH)2溶液稀释为2L,pH=12
D.pH=8的NaOH溶液稀释100倍,其pH=6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
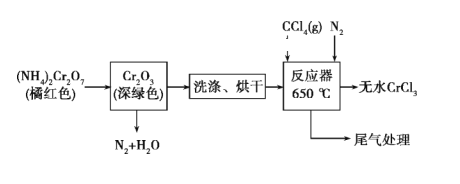
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因是________,如何判断其已洗涤干净:_____
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜加热方式是______。
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应管进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→________。
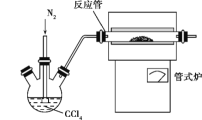
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4 ![]() 2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
(5)样品中三氯化铬质量分数的测定
称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol/L H2SO4溶液至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1 g KI,塞上塞子,摇匀,于暗处静置5分钟后,加入1 mL指示剂,用0.025 0 mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。已知Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O, 2Na2S2O3+I2
2Cr3++3I2+7H2O, 2Na2S2O3+I2![]() Na2S4O6+2NaI。
Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是____。
③样品中无水三氯化铬的质量分数为____(结果保留一位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2A为二元弱酸,常温下,向一定体积的0.1 mol·L-1的H2A溶液中逐滴加入一定浓度的NaOH溶液,溶液中不同形态的粒子(H2A、HA-、A2- )的物质的量分数a(X)随pH的变化曲线如图所示,![]()
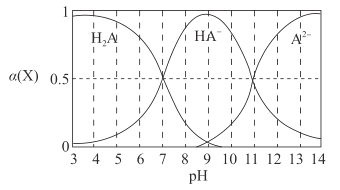
下列说法错误的是
A.K1(H2A)=1.0×10 -7B.K2(H2A)=1.0×10-11
C.pH=9时,c(Na+ )<c(HA- )+ 2c(H2A)D.pH=7时,c(Na+ )=c(H2A)+2c(A2- )
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是重要的化工原料。具有较强的还原性,可用于棉织物漂白后的脱氯剂,定量分析中的还原剂。易溶于水,不溶于乙醇。Na2S2O35H2O于40~45℃熔化,48℃分解。实验室中常用亚硫酸钠和硫磺制备Na2S2O35H2O。制备原理为:Na2SO3+S+5H2O═Na2S2O35H2O。某化学兴趣小组在实验室制备硫代硫酸钠晶体并探究其化学性质。
Ⅰ.实验室制取Na2S2O35H2O晶体的步骤如下:
①称取12.6 g Na2SO3于烧杯中,溶于80.0 mL水。
②另取4.0 g硫粉,用少许乙醇润湿后,加到上述溶液中。
③水浴加热(如图1所示,部分装置略去),微沸,反应约1小时后过滤。
④滤液在经过蒸发浓缩、冷却结晶后析出Na2S2O35H2O晶体。
⑤进行减压过滤(如图2所示)、乙醇洗涤并干燥。请回答:
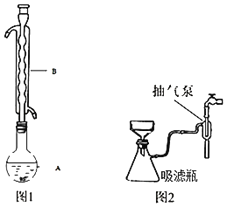
(1)仪器B的名称是_____。
(2)步骤④在浓缩过程中不能蒸发过度,其原因是_____。步骤⑤如欲停止抽滤,应先将吸滤瓶支管上的橡皮管拔下,再关抽气泵,其原因是_____。
(3)洗涤时为尽可能避免产品损失应选用的试剂是_____。
A.水 B.乙醇 C.氢氧化钠溶液 D.稀盐酸
Ⅱ.设计以下实验流程探究Na2S2O3的某些化学性质
![]()
(4)实验①Na2S2O3溶液pH=8的原因是_____(用离子方程式表示)。
(5)写出实验②中发生的离子反应方程式_____。
Ⅲ.用Na2S2O3的溶液测定溶液中ClO2的物质的量浓度,可进行以下实验。
步骤1:准确量取ClO2溶液10.00mL,稀释成100mL试样。
步骤2:量取V1 ML试样加入到锥形瓶中,调节试样的pH≤2.0,加入足量的KI晶体,摇匀,在暗处静置30分钟(已知:ClO2+I﹣+H+—I2+Cl﹣+H2O 未配平)。
步骤3:以淀粉溶液作指示剂,用c mol/L Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2 mL(已知:I2+2S2O32﹣=2I﹣+S4O62﹣)。
(6)滴定终点现象是_____。根据上述步骤计算出原ClO2溶液的物质的量浓度为_____ mol/L(用含字母的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com