
【题目】麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。
下列有关麦考酚酸说法正确的是( )
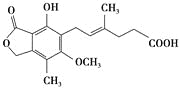
A.在一定条件下可与氢气发生加成反应,最多消耗氢气5 mol
B.不能与FeCl3溶液发生显色反应
C.在一定条件下可发生氧化、还原、取代、消去反应
D.1 mol麦考酚酸最多能与3 mol NaOH反应
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】现有反应:mA(g)+nB(g)![]() pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
pC(g),达到平衡后,当升高温度时,B的转化率变大;当减小压强时,混合体系中C的质量分数也减小,则:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加压时,A的质量分数_________。(填“增大”“减小”或“不变”,下同)
(3)若加入A(体积不变),则B的转化率_________。
(4)若降低温度,则平衡时B、C的浓度之比![]() 将_________。
将_________。
(5)若加入催化剂,平衡时气体混合物的总物质的量___________。
(6)若B是有色物质,A、C均无色,维持容器内压强不变,充入氖气时,混合物颜色_______(填“变深”“变浅”或“不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环戊烯是生产精细化工产品的重要中间体,其制备涉及的反应如下:
氢化反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烯)(l) H=-100.5 kJ/mol
(环戊烯)(l) H=-100.5 kJ/mol
副反应:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (环戊烷)(l) H=-109.4 kJ/mol
(环戊烷)(l) H=-109.4 kJ/mol
解聚反应: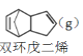
![]() 2
2![]() (g) H>0
(g) H>0
回答下列问题:
(1)反应![]() (l)+2H2(g)
(l)+2H2(g)![]()
![]() (l)的△H=_________ kJ/mol。
(l)的△H=_________ kJ/mol。
(2)一定条件下,将环戊二烯溶于有机溶剂进行氢化反应(不考虑二聚反应),反应过程中保持氢气压力不变,测得环戊烯和环戊烷的产率(以环戊二烯为原料计)随时间变化如图所示:
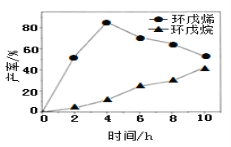
①0~4 h氢化反应速率比副反应快的可能原因是___________________。
②最佳的反应时间为_________h。若需迅速减慢甚至停止反应,可采取的措施有__________________(写一条即可)。
③一段时间后,环戊烯产率快速下降的原因可能是_____________________。
(3)解聚反应在刚性容器中进行(不考虑氢化反应和副反应)。
①其他条件不变,有利于提高双环戊二烯平衡转化率的是________(填标号)。
A.增大双环戊二烯的用量 B.使用催化剂 C.及时分离产物 D.适当提高温度
②实际生产中常通入水蒸气以降低双环戊二烯的温度(水蒸气不参与反应)。某温度下,通入总压为300 kPa的双环戊二烯和水蒸气,达到平衡后总压为500 kPa,双环戊二烯的转化率为80%,则 p(H2O)=________kPa,平衡常数Kp=__________kPa (Kp为以分压表示的平衡常数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究小组设计用含氯的有机物A合成棉织物免烫抗皱整理剂M的路线如下(部分反应试剂和条件未注明):

已知:①E的分子式为C5H8O4,能发生水解反应,核磁共振氢谱显示E分子内有2种不同化学环境的氢原子,其个数比为3∶1;

(R、R′、R″代表相同或不相同的烃基)。
(1)A分子中的含氧官能团的名称是________________。
(2)D→E反应的化学方程式是____________。
(3)A→B反应所需的试剂是________________。
(4)G→H反应的化学方程式是____________。
(5)已知1 mol E与2 mol J反应生成1 mol M,则M的结构简式是________。
(6)E的同分异构体有下列性质:①能与NaHCO3反应生成CO2;②能发生水解反应,且水解产物之一能发生银镜反应,则该同分异构体共有________种,其中任意1种的结构简式是________。
(7)J可合成高分子化合物,该高分子化合物的结构简式是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PCl3是磷的常见氯化物,可用于半导体生产的外延、扩散工序。有关物质的部分性质如下:
熔点/℃ | 沸点/℃ | 密度/ g·mL-1 | 其他 | |
黄磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制备
如图是实验室制备PCl3的装置(部分仪器已省略)。

(1)仪器乙的名称是________;其中,与自来水进水管连接的接口编号是________。(填“a”或“b”)
(2)实验室制备Cl2的离子方程式___________________________。实验过程中,为减少PCl5的生成,应控制____________。
(3)碱石灰的作用:一是防止空气中的水蒸气进入而使PCl3水解,影响产品的纯度;二是_________。
(4)向仪器甲中通入干燥Cl2之前,应先通入一段时间CO2排尽装置中的空气,其目的是________。
(二)分析
测定产品中PCl3纯度的方法如下:迅速称取4.100 g产品,水解完全后配成500 mL溶液,取出25.00 mL加入过量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反应后再用0.100 0 mol·L-1 Na2S2O3溶液滴定过量的碘,终点时消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假设测定过程中没有其他反应。
(5)根据上述数据,该产品中PCl3(相对分子质量为137.5)的质量分数为________。若滴定终点时俯视读数,则PCl3的质量分数________(填“偏大”“偏小”或“无影响”)。
(三)探究
(6)设计实验证明PCl3具有还原性:_____________________________________。(限选试剂有:蒸馏水、稀盐酸、碘水、淀粉)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X是一种环境激素,存在如图转化关系:
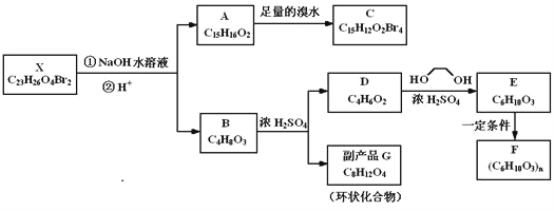
化合物A能与FeCl3溶液发生显色反应,分子中含有两个化学环境完全相同的甲基,其苯环上的一硝基取代物只有两种。1H﹣NMR谱显示化合物G的所有氢原子化学环境相同。F是一种可用于制备隐形眼镜的高聚物。根据以上信息回答下列问题:
(1)下列叙述正确的是__;
a.化合物A分子中含有联苯结构单元
b.化合物A可以和NaHCO3溶液反应,放出CO2气体
c.X与NaOH溶液反应,理论上1mol X最多消耗6mol NaOH
d.化合物D能与Br2发生加成反应
(2)化合物C的结构简式是__,A→C的反应类型是__;
(3)写出同时满足下列条件的D的所有同分异构体的结构简式(不考虑立体异构)__;
a.属于酯类 b.能发生银镜反应
(4)写出B→G反应的化学方程式__;
(5)写出E→F反应的化学方程式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“麻黄素”是中枢神经兴奋剂,其合成路线如图所示:
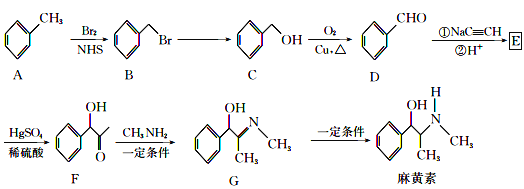
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能团的名称为__。
(2)B→C的反应条件是__,反应类型是__,E的结构简式为__。
(3)写出C→D的化学反应方程式__。
(4)麻黄素的分子式为__。
(5)H是G的同系物,也含醇羟基和碳氮双键,相对分子质量比G小28,且苯环上仅有一个侧链,则H的可能结构有___种(不考虑![]() 结构)。
结构)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂
R-CH=CH-R,请仿照题中流程图合成路线,设计以乙醇为起始主原料合成强吸水性树脂![]() 的合成路线,其它试剂及溶剂任选__。
的合成路线,其它试剂及溶剂任选__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将pH=12的NaOH溶液平均分成两份,一份加水V1 L,另一份加入与该NaOH溶液物质的量浓度相等的硫酸V2 L,pH都降低了1,则V1 :V2 为(溶液体积可以叠加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向硝酸酸化的2 mL 0.1 mol·L-1 AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈棕黄色,试管底部仍存在黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行了如下探究。
Ⅰ.探究Fe2+产生的原因。
(1)提出猜想:Fe2+可能是Fe与________或________反应的产物。(均填化学式)
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5 min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液。
液体试剂 | 加入铁氰化 | |
钾溶液 | ||
1号试管 | 2 mL 0.1 mol·L-1 | |
AgNO3溶液 | 无蓝色沉淀 | |
2号试管 | 硝酸酸化的2 mL 0.1 mol·L-1______溶液(pH=2) | 蓝色沉淀 |
①2号试管中所用的试剂为_________。
②资料显示:该温度下,0.1 mol·L-1 AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为_______。
③小组同学继续进行实验,证明了由2号试管得出的结论正确。实验如下:取100 mL 0.1 mol·L-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉并搅拌,分别插入pH传感器和NO![]() 传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
传感器(传感器可检测离子浓度),得到图甲、图乙,其中pH传感器测得的图示为________(填“图甲”或“图乙”)。
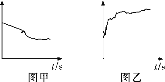
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为__________。
Ⅱ.探究Fe3+产生的原因。
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化了。小组同学设计了不同的实验方案对此进行验证。
(3)方案一:取出少量黑色固体,洗涤后,______(填操作和现象),证明黑色固体中有Ag。
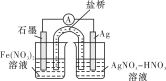
(4)方案二:按下图连接装置,一段时间后取出左侧烧杯中的溶液,加入KSCN溶液,溶液变红。该实验现象________(填“能”或“不能”)证明Fe2+可被Ag+氧化,理由为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com