
【题目】三氯化铬是化学合成中的常见物质,三氯化铬易升华,在高温下能被氧气氧化,碱性条件下能被H2O2氧化为Cr(Ⅵ)。制三氯化铬的流程如下:
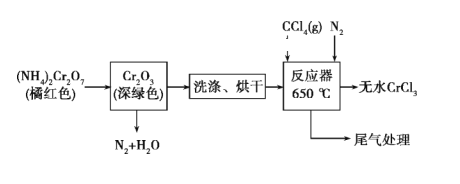
(1)重铬酸铵分解产生的三氧化二铬(Cr2O3难溶于水)需用蒸馏水洗涤的原因是________,如何判断其已洗涤干净:_____
(2)已知CCl4沸点为76.8 ℃,为保证稳定的CCl4气流,适宜加热方式是______。
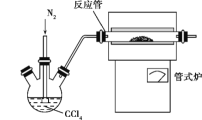
(3)用如图装置制备CrCl3时,主要步骤包括:①将产物收集到蒸发皿中;②加热反应管至400 ℃,开始向三颈烧瓶中通入氮气,使CCl4蒸气经氮气载入反应管进行反应,继续升温到650 ℃;③三颈烧瓶中装入150 mL CCl4,并加热CCl4,温度控制在50~60 ℃之间;④反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源;⑤停止加热CCl4,继续通入氮气;⑥检查装置气密性。正确的顺序为:⑥→③→________。
(4)已知反应管中发生的主要反应有:Cr2O3+3CCl4 ![]() 2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
2CrCl3+3COCl2,因光气有剧毒,实验需在通风橱中进行,并用乙醇处理COCl2,生成一种含氧酸酯(C5H10O3),用乙醇处理尾气的化学方程式为_____。
(5)样品中三氯化铬质量分数的测定
称取样品0.330 0 g,加水溶解并定容于250 mL容量瓶中。移取25.00 mL于碘量瓶(一种带塞的锥形瓶)中,加热至沸腾后加入1 g Na2O2,充分加热煮沸,适当稀释,然后加入过量的2 mol/L H2SO4溶液至溶液呈强酸性,此时铬以Cr2O72-存在,再加入1.1 g KI,塞上塞子,摇匀,于暗处静置5分钟后,加入1 mL指示剂,用0.025 0 mol/L硫代硫酸钠溶液滴定至终点,平行测定三次,平均消耗标准硫代硫酸钠溶液24.00 mL。已知Cr2O72-+6I-+14H+![]() 2Cr3++3I2+7H2O, 2Na2S2O3+I2
2Cr3++3I2+7H2O, 2Na2S2O3+I2![]() Na2S4O6+2NaI。
Na2S4O6+2NaI。
①该实验可选用的指示剂名称为______。
②移入碘量瓶的CrCl3溶液需加热煮沸,加入Na2O2后也要加热煮沸,其主要原因是____。
③样品中无水三氯化铬的质量分数为____(结果保留一位小数)。
【答案】除去其中的可溶性杂质(或除去固体表面的重铬酸铵溶液) 取最后一次洗涤液于试管中,向其中加入适量氢氧化钠浓溶液,加热,取一片红色石蕊试纸润湿,粘在玻璃棒上,接近试管口,观察试纸是否变蓝,若不变蓝,则说明已洗涤干净(合理即可) 水浴加热(并用温度计指示温度) ②→④→⑤→① COCl2+2C2H5OH![]() C2H5OCOOC2H5+2HCl 淀粉溶液 除去其中溶解的氧气,防止O2将I-氧化,产生误差 96.1%
C2H5OCOOC2H5+2HCl 淀粉溶液 除去其中溶解的氧气,防止O2将I-氧化,产生误差 96.1%
【解析】
重铬酸铵分解不完全,还可能含有其它可溶性杂质;因为(NH4)2Cr2O7显桔红色,所以可以提供颜色来判断;因为CCl4沸点为76.8°C,温度比较低,因此保证稳定的CCl4气流,可以通过水浴加热来控制其流量;由(4)可知反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在管式炉中反应管与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿;由分子式可知,COCl2中的2个Cl原子被2个-OC2H5代替,故乙醇与COCl2发生取代反应,-OC2H5取代氯原子生成C2H5OCOC2H5与HCl;利用Na2S2O3滴定生成I2,I2遇淀粉显蓝色,可以用淀粉作指示剂;溶液中有溶解的氧气,氧气可以氧化I-,若不除去其中溶解的氧气使生成的I2的量增大,产生偏高的误差;由Cr元素守恒及方程式可得关系式2Cr3+~Cr2O72-~3I2~6Na2S2O3,根据关系式计算。据此分析。
(1)重铬酸铵分解不完全,还可能含有其他可溶性杂质,用蒸馏水洗涤除去其中的可溶性杂质或除去固体表面的重铬酸铵溶液;因为(NH4)2Cr2O7属于铵盐,可以通过检验铵根离子的方法检验是否洗净:取最后一次洗涤液于试管中,向其中加入适量氢氧化钠浓溶液,加热,取一片红色石蕊试纸润湿,粘在玻璃棒上,接近试管口,观察试纸是否变蓝,若不变蓝,则说明已洗涤干净;
(2)因为CCl4沸点为76.8 ℃,温度比较低,因此为保证稳定的CCl4气流,可以通过水浴加热来控制,并用温度计指示温度;
(3)反应制备原理为Cr2O3+3CCl4→2CrCl3+3COCl2,四氯化碳在反应管中与Cr2O3反应,反应管出口端出现了CrCl3升华物时,切断加热管式炉的电源,停止加热CCl4,继续通入氮气,将产物收集到蒸发皿,操作顺序为:⑥→③→②→④→⑤→①;
(4)由该含氧酸酯的分子式可知COCl2中的2个Cl原子被2个—OC2H5代替,故乙醇与COCl2发生取代反应,—OC2H5取代氯原子生成C2H5OCOC2H5与HCl,方程式为COCl2+2C2H5OH→ C2H5OCOOC2H5+2HCl;
(5)①利用Na2S2O3标准溶液滴定生成的I2,I2遇淀粉显蓝色,可以用淀粉溶液作指示剂;②溶液中有溶解的氧气,氧气可以氧化I-,若不除去其中溶解的氧气会使生成的I2的量增大,产生误差;③设25.00 mL溶液中含有n(Cr3+),由Cr元素守恒及方程式可得关系式:2Cr3+~Cr2O72-~3I2~6Na2S2O3,根据关系式计算:
故n(Cr3+)=![]() ,所以250 mL溶液中n'(Cr3+)=
,所以250 mL溶液中n'(Cr3+)=![]() ,根据Cr元素守恒可知n(CrCl3)=n'(Cr3+)=0.002 mol,所以样品中m(CrCl3)=0.002 mol×158.5 g/mol=0.317g,故样品中三氯化铬的质量分数为
,根据Cr元素守恒可知n(CrCl3)=n'(Cr3+)=0.002 mol,所以样品中m(CrCl3)=0.002 mol×158.5 g/mol=0.317g,故样品中三氯化铬的质量分数为![]() 。
。


科目:高中化学 来源: 题型:
【题目】化学与生活密切相关.
(1)下列生活用品中,其主要材料属于天然纤维的是_________(填字母序号);
A.塑料保鲜薄 B.橡胶手套 C.棉布围裙
(2)我们常用的洗涤剂清洗餐具上的油污,这是因为洗涤剂具有_________的功能;
(3)食用水果、蔬菜主要补充人体所需的_________;
(4)国家禁止在面粉中添加增白剂过氧化钙CaO2,过氧化钙中氧元素的化合价为_______;
(5)农业上降低土壤酸性的是_________(填化学式);
(6)生活中要用到大量的钢铁,写出赤铁矿(主要成分Fe2O3)冶炼成铁的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂DEHP的作用类似于人工荷尔蒙,会危害男性生殖能力并促使女性性早熟,长期大量摄取会导致肝癌.其毒性远高于三聚氰胺,会造成免疫力及生殖力下降.下列关于塑化剂邻苯二甲酸二正丁酯说法不正确的是( )
A.分子式为C16H22O4,可由石油化工原料通过取代,氧化,酯化反应制得
B.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
C.用核磁共振氢谱分析有6个吸收峰
D.邻苯二甲酸二正丁酯能发生加成,取代和氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向CH3COONa稀溶液中加入(或通入)少许X物质,其溶液中部分微粒浓度变化如下表所示(溶液温度不变):
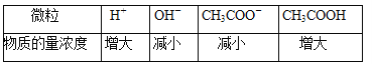
则X物质可能是( )
A.氯化氢B.氢氧化钠C.蒸馏水D.醋酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图所示。下列关于该有机物的说法正确的是
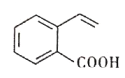
A. 1mol 该有机物最多与4molH2反应生成C9H16O2
B. 该有机物中所有碳原子不可能处于同一平面上
C. 该有机物能发生酯化、加成、氧化、水解等反应
D. 与该有机物具有相同官能团的同分异构体有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知难溶电解质在水溶液中存在溶解平衡MmAn(s)![]() mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
mMn+(aq)+nAm-(aq),Ksp=cm(Mn+)·cn(Am-)称为溶度积。
某学习小组欲探究CaSO4沉淀转化为CaCO3沉淀的可能性,查得如下资料(25℃):
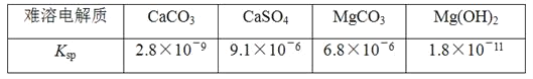
他们的实验步骤如下:
①往100mL0.1mol·L-1的CaCl2溶液中加入0.1mol·L-1的Na2SO4溶液100mL立即有白色沉淀生成。
②向上述悬浊液中加入固体Na2CO33g,搅拌,静置后弃去上层清液。
③再加入蒸馏水搅拌,静置后再弃去上层清液。
④___________________________。
(1)由题中信息知Ksp越大,表示电解质的溶解度越__(填“大”或“小”)。
(2)写出第②步发生反应的化学方程式__。
(3)设计第③步的目的是什么__。
(4)请补充第④步操作及发生的现象__。
(5)请写出该转化在实际生活、生产中的一个应用__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是
A.1 mol/L的NH4Br溶液中通人适量氨气呈中性,此时溶液中NH4+的数目为NA
B.25 °C时,Ksp (BaCO3)=2.5×10-9 ,则BaCO3饱和溶液中Ba2+ 的浓度为5×10-5 mol/L
C.100g 17%双氧水中含有H原子的数目为NA
D.28g N2和CO的混合气体中含有的氧原子的数目为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高温下,超氧化钾晶体(KO2)呈立方体结构。如图为超氧化钾晶体的一个晶胞(晶体中最小的重复单元)。则下列有关说法正确的是( )

A. KO2中只存在离子键
B. 超氧化钾的化学式为KO2,每个晶胞含有1个K+和1个O2-
C. 晶体中与每个K+距离最近的O2-有6个
D. 晶体中,所有原子之间都以离子键相结合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写热化学方程式:
(1)已知稀溶液中,1 mol H2SO4与NaOH溶液恰好完全反应时,放出114.6 kJ热量,写出表示H2SO4与NaOH反应的中和热的热化学方程式____________________________。
(2)碳的燃烧热为393.50 kJ·mol-1,写出表示C燃烧热的热化学方程式:______________。
(3)已知CO转化成CO2的能量关系如下图所示。写出该反应的热化学方程式:_______。

(4)25℃、101 kPa条件下充分燃烧一定量的丁烷气体放出热量为Q kJ,经测定,将生成的CO2通入足量澄清石灰水中产生25 g白色沉淀,写出表示丁烷燃烧热的热化学方程式________。
(5)已知下列热化学方程式:
①CH3COOH(l)+2O2(g)===2CO2(g)+2H2O(l) ΔH1=-870.3 kJ/mol
②C(s)+O2(g)===CO2(g) ΔH2=-393.5 kJ/mol
③H2(g)+![]() O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
O2(g)===H2O(l)ΔH3=-285.8 kJ/mol
写出由C(s)、H2(g)和O2(g)化合生成CH3COOH(l)的热化学方程式_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com