
【题目】下列有关说法不正确的是( )
A.天然油脂都是混合物,没有恒定的熔点和沸点
B.用饱和Na2CO3溶液可以除去乙酸乙酯中的乙酸
C.![]() 的名称为2-乙基丙烷
的名称为2-乙基丙烷
D.有机物![]() 分子中所有碳原子不可能在同一个平面上
分子中所有碳原子不可能在同一个平面上
科目:高中化学 来源: 题型:
【题目】铅蓄电池的充放电反应为Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
2PbSO4(s)+2H2O(1)。某铅蓄电池的正、负极标记被磨损,试用如困装置设计实验,识别出此铅蓄电池的正、负极。
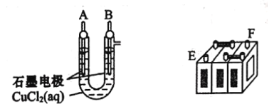
(1)将A接E、B接F,B电极出现_____________现象,电极反应式为_____________,说明F为正极。
(2)铅蓄电池工作时(放电),E电极的反应式为_____________,充电时该极与外接电源的_____________极相连。
(3)若有0.2mol电子发生转移,则正极消耗PbO2的物质的量是______mol。
(4)如图是在金属锌板上贴上一张用某溶液浸湿的滤纸。
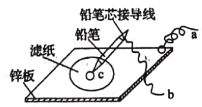
①若用硫酸钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则滤纸出现____色,铅笔芯c点处的电极反应式为________________。
②若用KI-淀粉溶液浸湿滤纸,用导线将a、b与铅蓄电池的E、F电极相连,铅笔芯c点处出现蓝色,则b接的是_______(填“E”或“F”)电极。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 周期 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | VA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ |
请按要求回答下列问题:
(1)元素①与⑨组成的化合物的电子式:_______;元素②的原子结构示意图_______。
(2)对比相同条件下元素⑥、⑦的单质分别与水反应的剧烈程度,可得到的结论:同一周期元素,随核电荷数的增加,_______;写出元素⑥的单质与水反应的化学方程式_______。
(3)能说明元素⑤的非金属性强于元素⑨的依据是_______。
(4)元素①与②所形成的最简单有机物的结构式是_______。元素①与②所形成的最简单烯烃为M,写出M与元素①的单质在一定条件下反应的化学方程式:_______,该反应类型为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】联氨(又称联肼,N2H4,无色液体)是一种应用广泛的化工原料,可用作火箭燃料,回答下列问题:
(1)联氨分子的电子式为__。
(2)实验室可用次氯酸钠溶液与氨反应制备联氨,反应的化学方程式为:___。
(3)①2O2(g)+N2(g)=N2O4(l) △H1
②N2(g)+2H2(g)=N2H4(l) △H2
③O2(g)+2H2(g)=2H2O(g) △H3
写出联氨和N2O4作为火箭推进剂反应的热化学方程式(△H用含△H1,△H2,△H3的代数式表示)___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甘氨酸亚铁![]() 是一种补铁强化剂。实验室利用
是一种补铁强化剂。实验室利用![]() 与甘氨酸
与甘氨酸![]() 制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。
制备甘氨酸亚铁,实验装置如下图所示(夹持和加热仪器已省略)。

查阅资料:
①甘氨酸易溶于水,微溶于乙醇;甘氨酸亚铁易溶于水,难溶于乙醇。
②柠檬酸易溶于水和乙醇,具有较强的还原性和酸性。
实验过程:
I.装置C中盛有17.4g![]() 和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
和200mL1.0mol·L-1甘氨酸溶液。实验时,先打开仪器a的活塞,待装置c中空气排净后,加热并不断搅拌;然后向三颈瓶中滴加柠檬酸溶液。
Ⅱ.反应结束后过滤,将滤液进行蒸发浓缩;加入无水乙醇,过滤、洗涤并干燥。
(1)仪器a的名称是________;与a相比,仪器b的优点是________。
(2)装置B中盛有的试剂是:_______;装置D的作用是________。
(3)向![]() 溶液中加入
溶液中加入![]() 溶液可制得
溶液可制得![]() ,该反应的离子方程式为________。
,该反应的离子方程式为________。
(4)过程I加入柠檬酸促进![]() 溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
溶解并调节溶液pH,溶液pH与甘氨酸亚铁产率的关系如图所示。
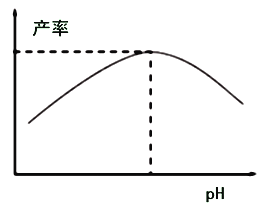
①pH过低或过高均导致产率下降,pH过高导致产率下降其原因是________;
②柠檬酸的作用还有________。
(5)过程II中加入无水乙醇的目的是________。
(6)本实验制得15.3g甘氨酸亚铁,则其产率是_______%。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铵明矾[NH4Al(SO4)2·12H2O]是分析化学常用基准试剂,其制备过程如下。下列分析不正确的是( )

A.过程Ⅰ反应:2NH4HCO3+Na2SO4=2NaHCO3↓+(NH4)2SO4
B.检验溶液B中阴离子的试剂仅需BaCl2溶液
C.若省略过程Ⅱ,则铵明矾产率明显减小
D.向铵明矾溶液中逐滴加入NaOH溶液并加热,先后观察到:刺激性气体逸出→白色沉淀生成→白色沉淀消失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20 mL某浓度的硫酸溶液中滴入0.1 mol·L-1氨水,溶液中水电离出的氢离子浓度随加入氨水的体积变化如图所示。下列分析正确的是
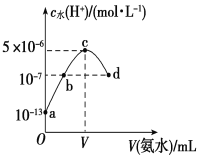
A.c点所示溶液中:c(H+)-c(OH-)=c(NH3·H2O)
B.b点所示溶液中:c(NH4+)=2 c(SO42-)
C.V=40
D.该硫酸的浓度为0.1 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁铝(PFAS)是一种新型高效水处理剂。利用硫铁矿烧渣(主要成分为Fe3O4、FeO、SiO2等)为铁源,粉煤灰(主要成分为Ai2O3、 Fe2O3 、FeO等)为铝源,制备PFAS的工艺流程如下:

(1)“碱溶”时,Ai2O3发生反应的化学方程式____________ 。
(2)“酸溶II”时 ,Fe3O4发生反应的离子方程式为_________
(3)“滤渣I”、“滤渣II”在本流程中能加以利用的是________
(4)酸度对絮凝效果和水质有显著影响。若产品PFAS中残留硫酸过多,使用时产生的不良后果是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H3AsO3与SnCl2在浓盐酸中反应的离子方程式为3Sn2++2H3AsO3+6H++18Cl-=2As+3SnCl62-+6M。关于该反应的说法中错误的是
A.M为H2O
B.还原剂是Sn2+,还原产物是As
C.氧化性:H3AsO3>SnCl62-
D.每生成7.5 g As,转移的电子为0.6 mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com