
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
| A、H3PO4?T3H++PO43- |
| B、HCO3-+H2O?H3O++CO32- |
| C、CH3COONH4?CH3COO-+NH4+ |
| D、NaHS═Na++H++S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:
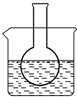 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用Na2CO3溶液不能区分CH3COOH和CH3COOCH2CH3 |
| B、将碘酒滴在鸡蛋清中,可观察到鸡蛋清显蓝色 |
| C、乙酸的酯化反应和苯的硝化反应属于同种反应类型 |
| D、乙烯能够发生加成反应,结构简式为CH2CH2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 气 体 | 所需试剂 | |
| <1> | ||
| <2> | ||
| <3> |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com