
【题目】随原子序数递增,八种短周期元素(用字母x……表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
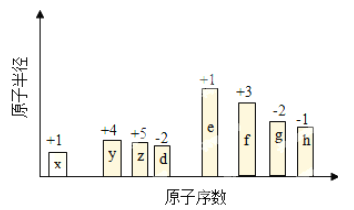
回答下列问题:
(1)H的离子结构示意图为__________________________。
(2)由E和D两元素形成的原子个数比为1∶1的化合物的电子式为______________。
(3)单质G易溶于YG2,则YG2的结构式为_______________。
(4)Z2X4是一种高效清洁的火箭燃料,8g该物质含有的共用电子对数目为_____________。
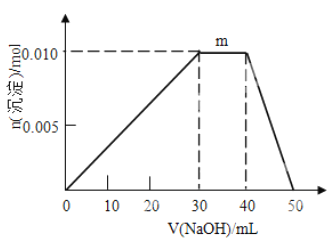
(5)上述元素可组成盐R:ZX4F(GD4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如图所示,则m点对应的离子方程式为_____________。
【答案】 ![]()
![]() S=C=S 1.25 NA(或1.25×6.02×1023) NH4++OH-=NH3H2O
S=C=S 1.25 NA(或1.25×6.02×1023) NH4++OH-=NH3H2O
【解析】从图中原子半径的相对大小、最高正价或最低负价及原子序数可知:X―H元素, Y―C元素 ,Z―N元素 ,D―O元素 ,E―Na元素, F―Al元素, G―S元素 ,H―Cl元素
(1)H的离子Cl― 结构示意图为![]() ;(2)由E和D两元素形成的原子个数比为1∶1的化合物Na2O2的电子式为
;(2)由E和D两元素形成的原子个数比为1∶1的化合物Na2O2的电子式为![]() ;(3)单质G易溶于YG2,即S易溶于CS2,则YG2的结构式为S=C=S;
;(3)单质G易溶于YG2,即S易溶于CS2,则YG2的结构式为S=C=S;
(4)N2H4+O2=N2+2H2O 转移电子
1mol 4mol
8/32mol n
n=1.25mol
(5)上述元素可组成盐R:NH4Al(SO4)2 与NaOH反应的图可知:三个阶段的反应及现象分别是:白色沉淀:2NH4Al(SO4)2 + 6NaOH ![]() 3Na2SO4 + (NH4)2SO4 +Al(OH)3↓,刺激性气味:2NaOH + (NH4)2SO4
3Na2SO4 + (NH4)2SO4 +Al(OH)3↓,刺激性气味:2NaOH + (NH4)2SO4 ![]() Na2SO4 + 2H2O + 2NH3↑,Al(OH)3 + NaOH
Na2SO4 + 2H2O + 2NH3↑,Al(OH)3 + NaOH ![]() NaAlO2 + 2H2O,故m点对应的离子方程式为NH4++OH-=NH3H2O。
NaAlO2 + 2H2O,故m点对应的离子方程式为NH4++OH-=NH3H2O。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,请用化学用语回答有关问题:
族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
2 | ① | ② | ||||||
3 | ⑨ | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
(1)①和⑧的元素符号是______和______;
(2)元素⑥形成的氢化物的电子式是______;
(3)表中能形成两性氢氧化物的元素是______(填写元素符号),请写出该元素的氢氧化物与⑨最高价氧化物对应的水化物发生反应的化学方程式_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A. H2SO4是酸,因为H2SO4中含有氢元素
B. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电池的“理论比能量”指单位质量的电极材料理论上能释放的最大电能。“金属(M)空气电池”(如下图)具有原料易得、能量密度高等优点。该类电池放电的总反应方程式为:4M+nO2+2nH2O=4M(OH) n。下列说法不正确的是

A. “金属(M)空气电池”放电过程的正极反应式: O2+2H2O+4e-=4OH-
B. 比较Mg、Al、Zn三种“金属—空气电池”,“Al—空气电池”的理论比能量最高
C. 电解质溶液中的阴离子从负极区移向正极区
D. 在“M—空气电池”中,为防止负极区沉积Mg(OH)2,宜采用中性电解质及阳离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】盆烯是近年合成的一种有机物,它的分子结构可简化表示为(其中C、H原子已略去),下列关于盆烯的说法中错误的是 ( )
![]()
A. 盆烯是苯的一种同分异构体
B. 盆烯分子中所有的碳原子不可能在同一平面上
C. 盆烯是乙烯的一种同系物
D. 盆烯在一定条件下可以发生加成反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知723K时,2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
2SO3(g) ΔH=-393.2 kJ/mol。维持723K,向一恒容的密闭容器A中通入2 mol SO2和1 mol O2,达到平衡时,放出热量Q1;维持723K,向另一个容积与A相同的恒容密闭容器B中通入1 mol SO2和0.5 mol O2,平衡时放出热量为Q2。下列判断不正确的是
A. 达到平衡时,以SO2表示的正反应速率A中比B中大
B. 达到平衡时,O2的转化率A中比B中大
C. 达到平衡时,混合气体的密度A中比B中小
D. 达到平衡时,放出的热量Q2< 1/2Q1 < 196.6 kJ
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com