
【题目】分类是化学学习中经常用到的方法,下列对一些物质或化学反应的分类以及依据正确的是( )
A. H2SO4是酸,因为H2SO4中含有氢元素
B. 豆浆是胶体,因为豆浆中的分散质粒子直径在1nm~100nm之间
C. Na和H2O的反应不是离子反应,因为反应中没有离子参加
D. Na在Cl2中燃烧不是氧化还原反应,因为没有得氧或失氧
科目:高中化学 来源: 题型:
【题目】在250C某稀溶液中,由水电离产生的c(H+)=10-13mol/L,下列有关溶液的叙述正确的是( )
A.该溶液一定呈酸性 B.该溶液一定呈碱性
C.该溶液的pH可能为1 D.该溶液的pH为7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述错误的是
A.共价化合物中只含共价键
B.离子化合物中可能含有共价键
C.干冰变为二氧化碳气体,因共价键被破坏需吸收能量
D.碳酸氢铵受热分解产生氨气不仅破坏离子键还破坏了共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】想一想:Ba(OH)2(固体) 、铜、 水(液体)这些物质为什么能归为一类,下列物质中还可以与它们归为一类的是( )
A.75%酒精 B.氢氧化铁胶体 C.硝酸钠 D.粗盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“温室效应”是全球关注的环境问题之一。CO2是目前大气中含量最高的一种温室气体,CO2的综合利用是解决温室及能源问题的有效途径。
(1)研究表明CO2和H2在催化剂存在下可发生反应生成CH3OH。己知部分反应的热化学方程式如下:
CH3OH(g)+![]() O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
O2(g) = CO2(g)+2H2O(1) △H1=akJmol-1
H2(g)+![]() O2(g) = H2O(1) △H2=bkJmol-1
O2(g) = H2O(1) △H2=bkJmol-1
H2O(g) = H2O(l) △H3=ckJmol-1
则 CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H=__________kJmol-1
CH3OH(g)+H2O(g) △H=__________kJmol-1
(2)CO2催化加氢也能合成低碳烯烃: 2CO2(g)+6H2(g)![]() C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。
C2H4(g)+4 H2O (g),不同温度下平衡时的四种气态物质的物质的量如图1所示,曲线b表示的物质为_______________ (写化学式)。

(3)CO2和H2在催化剂Cu/ZnO作用下可发生两个平行反应,分别生成CH3OH和CO。
反应 A:CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
反应B:CO2(g)+ H2(g)![]() CO(g)+H2O(g)
CO(g)+H2O(g)
控制CO2和H2初始投料比为1∶3时,温度对CO2平衡转化率及甲醇和CO产率的影响如图2所示。

① 由图2可知温度升高CO的产率上升,其主要原因可能是__________________。
② 由图2可知获取CH3OH最适宜的温度是________________,下列措施有利于提高CO2转化为CH3OH的平衡转化率的措施有__________________。
A.使用催化剂 B.增大体系压强
C.增大CO2和H2的初始投料比 D.投料比不变和容器体积不变,增加反应物的浓度
(4)在催化剂表面通过施加电压可将溶解在水中的二氧化碳直接转化为乙醇,则生成乙醇的电极反应式为______________________________________________________。
(5)由CO2制取C的太阳能工艺如图3所示。“热分解系统”发生的反应为:2Fe3O4![]() 6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。
6FeO+O2↑,每分解1mol Fe3O4转移电子的物质的量为_____________;“重整系统”发生反应的化学方程式为_____________________________________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学用语是表示物质组成、结构和变化规律的一种具有国际性、科学性和规范性的书面语言.化学用语具有简便、确切地表达化学知识和化学科学思维的特点.下列化学用语中书写正确的是( )
A. N2的电子式:![]()
B. 次氯酸的结构式:H-O-Cl
C. CO2分子的比例模型 :![]()
D. 用电子式表示氯化氢分子的形成过程:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知丙酮通常是无色的液体,与水互溶,密度小于1 g/mL ,沸点约为55℃。要将水与丙酮分离出来,选择的方法是( )
A.蒸馏 B.分液 C.过滤 D.蒸发
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x……表示)原子半径的相对大小、最高正价或最低负价的变化如图所示。
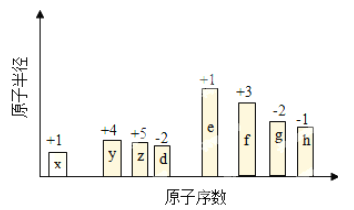
回答下列问题:
(1)H的离子结构示意图为__________________________。
(2)由E和D两元素形成的原子个数比为1∶1的化合物的电子式为______________。
(3)单质G易溶于YG2,则YG2的结构式为_______________。
(4)Z2X4是一种高效清洁的火箭燃料,8g该物质含有的共用电子对数目为_____________。
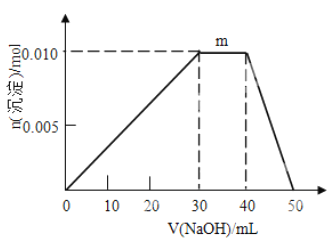
(5)上述元素可组成盐R:ZX4F(GD4)2。向盛有10mL1mol·L-1R溶液的烧杯中滴加1mol·L-1NaOH溶液,沉淀物质的量随NaOH溶液体积的变化如图所示,则m点对应的离子方程式为_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com