
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
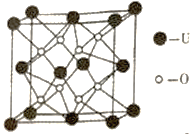
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
【答案】  CaF2和MgF2均为离子晶体,Mg2+半径小于Ca2+半径,MgF2的晶格能大于CaF2,故MgF2熔点比较高 ABC F>N>O>H BC 平面三角形
CaF2和MgF2均为离子晶体,Mg2+半径小于Ca2+半径,MgF2的晶格能大于CaF2,故MgF2熔点比较高 ABC F>N>O>H BC 平面三角形 ![]() sp2 sp 四面体 (4×270)/(NA× 8a3×10-21)
sp2 sp 四面体 (4×270)/(NA× 8a3×10-21)
【解析】(1)F原子的价电子为2s22p5,所以其价电子排布图为![]() 。MgF2和CaF2都是离子化合物,离子化合物的熔点高低取决于晶格能的大小,一般来说离子的半径越小,离子所带的电荷越高,晶格能越大,所以MgF2的熔点高于CaF2的原因是:CaF2和MgF2均为离子晶体,Mg2+半径小于Ca2+半径(离子的电荷都相同),MgF2的晶格能大于CaF2,故MgF2熔点比较高。
。MgF2和CaF2都是离子化合物,离子化合物的熔点高低取决于晶格能的大小,一般来说离子的半径越小,离子所带的电荷越高,晶格能越大,所以MgF2的熔点高于CaF2的原因是:CaF2和MgF2均为离子晶体,Mg2+半径小于Ca2+半径(离子的电荷都相同),MgF2的晶格能大于CaF2,故MgF2熔点比较高。
(2)①NH4HF2是一种铵盐,属于离子化合物,存在离子键;铵根离子内部存在N和H之间的共价键,同时存在一个N→H的配位键。所以答案为ABC。
②同周期元素从左向右第一电离能逐渐增大,因为N的p能级是半满的稳定结构,所以其第一电离能高于O,因此第一电离能的顺序为:F>N>O>H。
(3)①氨气分子空间构型是三角锥形,水分子是折线形,两者都是极性分子。二氧化碳分子是直线形分子所以二氧化碳是非极性分子,N2明显是非极性分子,选项BC正确。
②根据价层电子对互斥理论,碳酸根离子的中心C原子的价电子对为3+(4+2-2×3)=3对,所以该离子的空间构型为平面三角形。碳酸根离子一共有4个原子,所以m=4。中心C原子做sp2杂化,剩余一个价电子;周围的O原子的2p能级上有两个单电子,其中一个单电子用来和中心C原子成σ键,剩余的一个单电子用来形成大![]() 键,所以三个氧原子一共提供3个电子;最后加上两个单位负电荷所对应的电子;所以成大
键,所以三个氧原子一共提供3个电子;最后加上两个单位负电荷所对应的电子;所以成大![]() 键的电子一共为6个,即n=6。所以该大
键的电子一共为6个,即n=6。所以该大![]() 键的表示为
键的表示为![]() 。
。
③根据图示的结构,第一个氮原子成键(H-N-N)的角度约为120°,所以第一个N的杂化应该是sp2杂化。中间氮原子,因为要和两边氮原子成直线,且要形成双键和三键,所以中间氮原子为sp杂化。
(4)①从图中得到氧原子填充在立方体晶胞分割出来的八个小立方体的体心位置,这个晶胞的结构与CaF2类似,所以氧原子填充四面体空隙。
②由晶胞图得到,两个氧原子之间的距离为晶胞边长的一半,所以晶胞边长为2a nm,即2a×10-7 cm,所以晶胞体积为(2a×10-7)3 = 8a3×10-21cm3。该晶胞中含有的U原子为8![]() + 6×
+ 6×![]() = 4个;含有的O原子为8个,所以一个晶胞中有4个UO2,其质量为
= 4个;含有的O原子为8个,所以一个晶胞中有4个UO2,其质量为![]() g。所以晶体的密度为(4×270)/(NA× 8a3×10-21)。
g。所以晶体的密度为(4×270)/(NA× 8a3×10-21)。


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:
【题目】下列物质中既能导电,又属于强电解质的一组物质是( )
A.石墨、醋酸溶液、食盐晶体
B.熔融状态的KOH、熔融状态的NaCl
C.稀H2SO4、NaOH溶液、纯HNO3
D.液氨、石灰水、水银
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是( )
氧化物 | 环境问题 | 主要来源 | |
A | CO2 | 酸雨 | 化石燃料的燃烧 |
B | CO | CO中毒 | 汽车尾气和化石燃料的不完全燃烧 |
C | NO2 | 温室效应 | 工厂废气的排放 |
D | SO2 | 光化学烟雾 | 汽车尾气的排放 |
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,A处通入潮湿的Cl2,关闭B阀时,C处干燥的红色布条看不到明显现象,打开B阀后,C处红色布条逐渐褪色,则D瓶中装的不可能是( )

A. 浓H2SO4 B. NaOH溶液 C. 澄清石灰水 D. 饱和NaCl溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.掌握仪器名称、组装及使用方法是中学化学实验的基础,如图为蒸馏实验装置。
(1)写出下列仪器的名称:a.__________; b.___________;
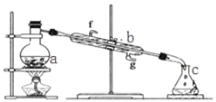
(2)实验过程中,需要通冷水,图中的进水方向是_______进(填图中字母);
(3)若利用装置分离乙酸(沸点118℃)和乙酸乙酯(沸点77℃)的混合物,还缺少的仪器是_______;
II.现用NaOH固体配制0.1 mol/L NaOH溶液480mL,据此回答下列问题:
(4)配制氢氧化钠溶液需要用到的玻璃仪器有烧杯、玻璃棒、胶头滴管和______;
(5)实验时需要称量氢氧化钠_______g;
(6)配制0.1 mol/L NaOH溶液的实验中,如果出现以下操作,会导致配制溶液的浓度偏大的有_______(填写字母)。
A.称量氢氧化钠固体时砝码放反了 B.未洗涤溶解NaOH的烧杯
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中
D.容量瓶未干燥即用来配制溶液 E.定容时俯视刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素W、X、Y、Z的原子序数依次增大:W、X、Y、Z组成的单质可发生如图所示的化学反应;B是生活中最常见的液体;常温下Y、Z组成的二元化合物的水溶液pH=7。下列说法错误的是

A. A与B的反应一定是化合反应
B. 离子半径:Z>X>Y>W
C. W、Y、Z均存在两种或两种以上的氧化物
D. 将等物质的量的A、C溶于同一烧杯水中,所得溶液的pH一定大于7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH4、CO2和碳酸都是碳的重要化合物,实现碳及其化合物的相互转化,对开发新能源和降低碳排放意义重大。
(1)已知:①CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H1=+206.1kJmol—1
CO(g)+3H2(g) △H1=+206.1kJmol—1
②2H2(g)+CO(g)![]() CH3OH(l) △H2=-128.3kJmol—1
CH3OH(l) △H2=-128.3kJmol—1
③2H2(g)+O2(g)=2H2O(g) △H3=-483.6kJmol—1
写出由甲烷和氧气合成液态甲醇的热化学方程式:_____________________。
(2)若利用反应①来制备氢气。为了探究温度、压强对反应①的影响,设计以下三组对比实验(温度为400℃或500℃,压强为101kPa或404kPa)。
实验序号 | 温度/℃ | 压强/kPa | CH4初始浓度/ mol·L—1 | H2O初始浓度/ mol·L—1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
Ⅰ、实验1、实验2和实验3比较,反应开始时正反应速率最快的是_________;平衡时CH4的转化率最小的是_________。
Ⅱ、实验2和实验3相比,其平衡常数关系:K2______K3(填“>”、“<”或“=”)。
(3)科学家提出由CO2制取碳(C)的太阳能工艺如图1所示.
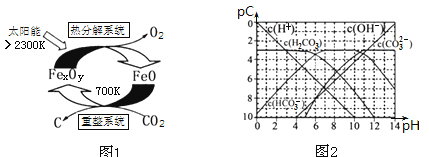
①“重整系统”发生的反应中n(FeO)∶n(CO2)=6∶1,则FexOy的化学式为______;
②“热分解系统”中每分解l mol FexOy,同时生成标准状况下气体体积为_______。
(4)pC类似pH,是指极稀溶液中的溶质浓度的常用负对数值。如某溶液中溶质的浓度为1×10—2molL—1,则该溶液中溶质的pC=﹣lg(1×10—2)=2。上图2为25℃时H2CO3溶液的pC﹣pH图。请回答下列问题:
①
②在8<pH<10时,溶液中HCO3—的pC值不随着pH增大而减小的原因是____;
③求H2CO3一级电离平衡常数的数值Ka1= _______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com