
【题目】下列物质中,既含有氯分子,又含有氯离子的是( )
A.氯气B.氯水C.盐酸D.氯化钠
科目:高中化学 来源: 题型:
【题目】要证明某溶液中含Fe2+而不含有Fe3+,进行如下实验操作时最佳顺序为( )
①加入足量氯水 ②观察到无现象 ③加入少量KSCN溶液
A.①③②B.③①②C.③②①D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 所有自发进行的化学反应都是放热反应
B. 同一物质固、液、气三种状态的熵值相同
C. △H < 0、△S > 0的反应可自发进行
D. 在其他条件不变的情况下,使用催化剂可以改变化学反应进行的方向
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】科学家开发出一种“洁净煤技术”,通过向地下煤层“气化炉”中交替鼓入空气和水蒸气的方法,连续产出高热值的煤炭气,其主要成分是CO和H2。“气化炉”中主要反应有:C(s)+ +H2O (g) =CO(g)+H2(g) △H= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) △H= — 41.2kJmol-1
(1)气化炉中CO2与C反应转化为CO,该反应的热化学方程式是 __________________________________。
(2)用煤炭气合成甲醇的反应为CO(g)+2H2(g) ![]() CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
CH3OH(g)。在密闭容器中,将CO和H2按物质的量1:2混合反应,CO的平衡转化率与温度、压强的关系如右图所示:
①生成甲醇的反应为_______(填“放热”或“吸热”)。
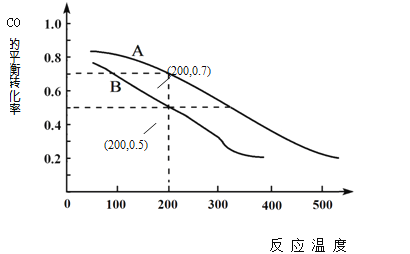
②图中两条曲线分别表示压强为0.1MPa和5.0MPa下CO转化率随温度的变化,其中代表压强是5.0MPa的曲线是____________(填“A”或“B”)。
③在不改变反应物用量的前提下,为提高CO转化率可采取的措施有 _______________________ 。
④压强为0.1MPa、温度为200℃时,平衡混合气中甲醇的物质的量分数是 _______________。
(3)某新型电池以熔融碳酸盐作电解质,在650℃下工作,负极通入煤炭气,正极通入空气与CO2的混合气.电池的正极反应式为O2+2CO2+4e-=2CO32—,负极反应式为 ___________________和_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 乙烷中含乙烯杂质可以加入氢气反应除去
B. C4H9Br的同分异构体有4种
C. 淀粉溶液中加入KI溶液,液体变蓝色
D. 苯(苯酚):向混合液中加入适量的浓溴水,过滤,除去苯中的少量苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物N(![]() )是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
)是一种常见的有机合成中间体,在生产中用途广泛。以有机物A为原料合成M和N的路线如下所示:
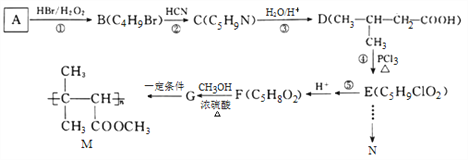
已知:I. ![]()
II. ![]()
请回答下列问题:
(1)A分子中共面的原子数最多为________个,-CN的电子式为_______________。
(2)②的反应类型为________________, E分子中所含官能团的名称为____________,G的结构简式为_____________________。
(3)写出反应⑤的化学方程式__________________________________________,写出M在酸性条件下水解的化学方程式_________________________________。
(4)D的同分异构体中,能发生银镜反应,且能与钠反应放出H2的共有______种,写出核磁共振氢谱有4组峰,且峰面积比为1:1:2:6的一种同分异构体的结构简式:____________________。
(5)结合信息,写出用E和乙醇为原料制备化合物N的合成路线:(其他试剂任选)_____________
![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】十九大报告提出要“打赢蓝天保卫战”,意味对环境污染防治比过去要求更高。
(1)烟气中的氮氧化物与悬浮在大气中海盐粒子的相互作用时,涉及如下反应:
2NO2(g)+NaCl(s)![]() NaNO3(s)+ClNO(g) H < 0 平衡常数K1
NaNO3(s)+ClNO(g) H < 0 平衡常数K1
2NO(g)+Cl2(g)![]() 2ClNO(g) H < 0 平衡常数K2
2ClNO(g) H < 0 平衡常数K2
4NO2(g)+2NaCl(s)![]() 2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
2NaNO3(s)+2NO(g)+Cl2(g)的平衡常数K=__________(用K1、K2表示)。
(2)利用CO可将NO转化为无害的N2,其反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)。
N2(g)+2CO2(g)。
在容积均为1 L的甲、乙、丙三个恒温(反应温度分别为300℃、T℃、300℃)容器中分别加入物质的量之比为1:1的NO和CO,测得各容器中n(CO)随反应时间t的变化情况如下表所示:
t/min n(CO) /mol | 0 | 40 | 80 | 120 | 160 |
甲 | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
乙 | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
丙 | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
① 甲容器中,0~40min内用NO的浓度变化表示的平均反应速率v(NO)=_______。
② T ___ 300℃,该反应的△H______0(填“>”或“<”)。
③ 甲容器达平衡时α(NO)=_______。
丙容器达平衡时c(NO)可能为________0.4mol/L(填“>”、“=”或“<”)。
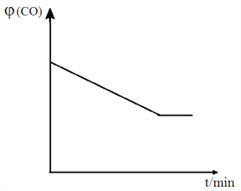
④ 已知甲容器CO的体积分数![]() (CO)随时间t的变化如图,画出其他条件不变,绝热条件下,
(CO)随时间t的变化如图,画出其他条件不变,绝热条件下, ![]() (CO)随时间t的变化示意图。_____________________
(CO)随时间t的变化示意图。_____________________
(3)处理含镉废水常用化学沉淀法。以下是几种镉的难溶化合物25℃时的溶度积常数: Ksp(CdCO3)=5.2×10-12 Ksp(CdS)=3.6×10-29 Ksp(Cd(OH)2)=2.0×10-16,
回答下列问题:
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。沉淀Cd2+效果最佳的试剂是____________
a.Na2CO3 b.Na2S c.CaO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铀是原子反应堆的原料,常见铀的化合物有UF4、UO2、及(NH4)4[UO2(CO3)3]等,回答下列问题:
(1)基态氟原子的价电子排布图为________________;用Mg或Ca还原UF4可得金属铀,其氧化产物MgF2的熔点高于CaF2,原因是_______________________________;
(2)已知:2UO2+5NH4HF2![]() 2UF4·2NH4F+3NH3↑+4H2O↑
2UF4·2NH4F+3NH3↑+4H2O↑
①NH4HF2中存在的微粒间的作用力是__________(填选项字母)。
A.离子键 B.配位键 C.共价键 D.范德华力
②该反应中非金属元素的第一电离能由大到小的顺序是__________(填元素符号)。
(3)已知:3(NH4)4[UO2(CO3)3] ![]() 3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
3UO2+10NH3↑+9CO2↑+ N2↑+ 9H2O↑
①分解产物中属于非极性分子的是_________(填选项字母)。
A.NH3 B.CO2 C.N2 D.H2O
②反应物中的CO32-的空间构型为_____________。分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则CO32-中的大
),则CO32-中的大![]() 键应表示为______________。
键应表示为______________。
③HN3(氢叠氮酸)常用于引爆剂,其分子的结构式可表示为:![]() 。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
。则左边氮原子和中间氮原子的杂化方式分别为______________、_______________。
(4)UO2的晶胞结构如图所示:
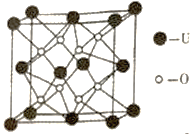
①晶胞中铀原子位于面心和顶点,氧原子填充在铀原子堆积形成的空隙中。则氧原子填充在铀原子形成的___________空隙中。(填“立方体”、“四面体”、“八面体”)
②若两个氧原子间的最短距离为a nm,则UO2晶体的密度为___________g·cm-3(列出计算式即可,设NA表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应自发性的说法正确的是
A. △H<0、△S>0的反应,有利于自发进行
B. 化合反应都是放热反应,分解反应都是吸热反应
C. 凡是放热反应都是自发的,吸热反应都是非自发的
D. 自发反应在任何条件下都能自动进行,现象明显
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com