
ЁОЬтФПЁППЦбЇМвПЊЗЂГівЛжжЁАНрОЛУКММЪѕЁБЃЌЭЈЙ§ЯђЕиЯТУКВуЁАЦјЛЏТЏЁБжаНЛЬцЙФШыПеЦјКЭЫЎеєЦјЕФЗНЗЈЃЌСЌајВњГіИпШШжЕЕФУКЬПЦјЃЌЦфжївЊГЩЗжЪЧCOКЭH2ЁЃЁАЦјЛЏТЏЁБжажївЊЗДгІгаЃКC(s)+ +H2O (g) =CO(g)+H2(g) ЁїH= +131.3 kJmol-1
CO(g)+H2O(g) =CO2(g)+H2(g) ЁїH= ЁЊ 41.2kJmol-1
ЃЈ1ЃЉЦјЛЏТЏжаCO2гыCЗДгІзЊЛЏЮЊCOЃЌИУЗДгІЕФШШЛЏбЇЗНГЬЪНЪЧ __________________________________ЁЃ
ЃЈ2ЃЉгУУКЬПЦјКЯГЩМзДМЕФЗДгІЮЊCO(g)+2H2(g) ![]() CH3OH(g)ЁЃдкУмБеШнЦїжаЃЌНЋCOКЭH2АДЮяжЪЕФСП1ЃК2ЛьКЯЗДгІЃЌCOЕФЦНКтзЊЛЏТЪгыЮТЖШЁЂбЙЧПЕФЙиЯЕШчгвЭМЫљЪОЃК
CH3OH(g)ЁЃдкУмБеШнЦїжаЃЌНЋCOКЭH2АДЮяжЪЕФСП1ЃК2ЛьКЯЗДгІЃЌCOЕФЦНКтзЊЛЏТЪгыЮТЖШЁЂбЙЧПЕФЙиЯЕШчгвЭМЫљЪОЃК
ЂйЩњГЩМзДМЕФЗДгІЮЊ_______ЃЈЬюЁАЗХШШЁБЛђЁАЮќШШЁБЃЉЁЃ
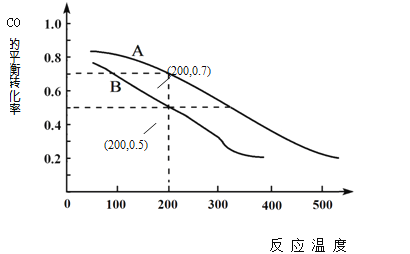
ЂкЭМжаСНЬѕЧњЯпЗжБ№БэЪОбЙЧПЮЊ0.1MPaКЭ5.0MPaЯТCOзЊЛЏТЪЫцЮТЖШЕФБфЛЏЃЌЦфжаДњБэбЙЧПЪЧ5.0MPaЕФЧњЯпЪЧ____________ЃЈЬюЁАAЁБЛђЁАBЁБЃЉЁЃ
ЂлдкВЛИФБфЗДгІЮягУСПЕФЧАЬсЯТЃЌЮЊЬсИпCOзЊЛЏТЪПЩВЩШЁЕФДыЪЉга _______________________ ЁЃ
ЂмбЙЧПЮЊ0.1MPaЁЂЮТЖШЮЊ200ЁцЪБЃЌЦНКтЛьКЯЦјжаМзДМЕФЮяжЪЕФСПЗжЪ§ЪЧ _______________ЁЃ
ЃЈ3ЃЉФГаТаЭЕчГивдШлШкЬМЫсбЮзїЕчНтжЪЃЌдк650ЁцЯТЙЄзїЃЌИКМЋЭЈШыУКЬПЦјЃЌе§МЋЭЈШыПеЦјгыCO2ЕФЛьКЯЦјЃЎЕчГиЕФе§МЋЗДгІЪНЮЊO2+2CO2+4e-=2CO32ЁЊЃЌИКМЋЗДгІЪНЮЊ ___________________КЭ_________________ЁЃ
ЁОД№АИЁП C(s)+CO2(g)=2CO(g) ЁїH=+172.5 kJmol-1 ЗХШШ A НЕЮТЁЂМгбЙ 25% H2+CO32--2e-=H2O+CO2 CO+CO32--2e-= 2CO2
ЁОНтЮіЁПЂХ. вбжЊЂй C(s)+ +H2O (g) =CO(g)+H2(g) ЁїH= +131.3 kJmol-1
Ђк CO(g)+H2O(g) =CO2(g)+H2(g) ЁїH= Ѓ41.2kJmol-1ЃЌРћгУИЧЫЙЖЈТЩНЋЂйЃЂкПЩЕУЃКC(s)+CO2(g)=2CO(g) ЁїH=+172.5 kJmol-1ЃЌЙЪД№АИЮЊЃКC(s)+CO2(g)=2CO(g) ЁїH=+172.5 kJmol-1ЃЛ
ЂЦ. Ђй. гЩЭМЯѓПЩжЊЃЌЫцЮТЖШЕФЩ§ИпCOЕФЦНКтзЊЛЏТЪНЕЕЭЃЌЫЕУїЩ§ЮТЪБЦНКтФцЯђвЦЖЏЃЌдђе§ЗДгІЮЊЗХШШЗДгІЃЌЙЪД№АИЮЊЃКЗХШШЃЛ
Ђк. ДгЗДгІЗНГЬЪНПЩжЊЃЌИУЗДгІЮЊЦјЬхЬхЛ§МѕаЁЕФЗДгІЃЌЫљвдбЙЧПдіДѓЪБЦНКте§ЯђвЦЖЏЃЌCOЕФЦНКтзЊЛЏТЪдіДѓЃЌМДзЊЛЏТЪИпЕФбЙЧПДѓЃЌЙЪД№АИЮЊЃКAЃЛ
Ђл. ЮЊЬсИпCOЕФзЊЛЏТЪЃЌМДвЊЪЙЦНКте§ЯђвЦЖЏЃЌИљОнЗДгІЗНГЬЪНПЩжЊЃЌдіДѓбЙЧППЩвдЪЙЦНКте§ЯђвЦЖЏЃЌгжвђИУЗДгІЪЧЗХШШЗДгІЃЌЫљвдНЕЕЭЮТЖШвВПЩвдЪЙЦНКте§ЯђвЦЖЏЃЌЙЪД№АИЮЊЃКНЕЮТЁЂМгбЙЃЛ
Ђм. дкУмБеШнЦїжаЃЌНЋCOКЭH2АДЮяжЪЕФСП1:2ЛьКЯЃЌЩшЦ№ЪМЪБМгШыCO amolЃЌдђМгШыH2 2amolЃЌНсКЯЭМЯѓПЩжЊЃЌбЙЧПЮЊ0.1MPaЁЂЮТЖШЮЊ200ЁцЪБЃЌCOЕФЦНКтзЊЛЏТЪЮЊ0.5ЃЌдђИљОнШ§ЖЮЪНЗЈгаЃК
CO(g)+2H2(g) ![]() CH3OH(g)
CH3OH(g)
Ц№ЪМ(mol) a 2a 0
зЊЛЏ(mol) 0.5a a 0.5a
ЦНКт(mol) 0.5a a 0.5a
ЫљвдЦНКтЛьКЯЦјжаМзДМЕФЮяжЪЕФСПЗжЪ§ЪЧЃК![]() ЁС100%=25%ЃЌЙЪД№АИЮЊЃК25%ЃЛ
ЁС100%=25%ЃЌЙЪД№АИЮЊЃК25%ЃЛ
ЂЧ. УКЬПЦјЕФжївЊГЩЗжЪЧCOКЭH2ЃЌдђИУаТаЭЕчГиЕФзмЗДгІЮЊЃКЂйO2+2CO=2CO2КЭЂк2H2+O2=2H2OЃЌвђИУЕчГиЕФе§МЋЗДгІЪНЮЊЂлO2+2CO2+4eЃ=2CO32ЃЃЌИљОнИКМЋЗДгІЪН=ЕчГизмЗДгІЪНЃе§МЋЗДгІЪНЃЌЂй-ЂлПЩЕУЃК2CO+2CO32ЃЃ4eЃ=4CO2ЃЌЛЏМђЕУCO+CO32ЃЃ2eЃ=2CO2ЃЌЂк-ЂлПЩЕУЃК2H2+2CO32ЃЃ4eЃ=2H2O+2CO2ЃЌЛЏМђЕУH2+CO32ЃЃ2eЃ=H2O+CO2ЃЌ
ЙЪД№АИЮЊЃКH2+CO32ЃЃ2eЃ=H2O+CO2ЁЂCO+CO32ЃЃ2eЃ=2CO2ЁЃ


 УћаЃПЮЬУЯЕСаД№АИ
УћаЃПЮЬУЯЕСаД№АИ
| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЗДгІЪєгкбѕЛЏЛЙдЗДгІЕФЪЧ
A. Na2CO3+2HCl=Na2CO3+CO2Ёќ+H2O B. H2O+CO2=H2CO3
C. 2Na2O2+2H2O=4NaOH+O2Ёќ D. 2Al(OH)3![]() Al2O3+3H2O
Al2O3+3H2O
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаМШФмЕМЕчЃЌгжЪєгкЧПЕчНтжЪЕФвЛзщЮяжЪЪЧЃЈ ЃЉ
A.ЪЏФЋЁЂДзЫсШмвКЁЂЪГбЮОЇЬх
B.ШлШкзДЬЌЕФKOHЁЂШлШкзДЬЌЕФNaCl
C.ЯЁH2SO4ЁЂNaOHШмвКЁЂДПHNO3
D.вКАБЁЂЪЏЛвЫЎЁЂЫЎвј
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаааЮЊВЛЗћКЯЪЕбщАВШЋвЊЧѓЕФЪЧЃЈ ЃЉ
A.ЯЈУ№ОЦОЋЕЦЪБЃЌгУЕЦУБИЧУ№
B.ЕуШМЧтЦјЧАЃЌЯШНјаабщДПВйзї
C.ХфжЦЯЁСђЫсЪБЃЌНЋХЈСђЫсЛКТ§ЕЙШыЫЎжаВЂВЛЖЯНСАш
D.ДѓСПТШЦјаЙТЉЪБЃЌбИЫйРыПЊЯжГЁВЂОЁСПЭљЕЭДІШЅ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСаШмвКжаИїСЃзгЕФЮяжЪЕФСПХЈЖШЙиЯЕе§ШЗЕФЪЧ
AЃЎ0.1 mol/L pHЮЊ4ЕФNaHBШмвКжаЃКc(HBЃ)>c(H2B)>c(B2Ѓ)
BЃЎЯрЭЌЬѕМўЯТЃЌpHЃН5ЕФЂйNH4ClШмвКЁЂЂкCH3COOHШмвКЁЂЂлЯЁбЮЫсШ§жжШмвКжагЩЫЎЕчРыГіЕФc(HЃЋ)ЃКЂй>Ђк>Ђл
CЃЎ0.2 mol/LЕФNaHCO3ШмвКгы0.3 mol/LЕФBa(OH)2ШмвКЕШЬхЛ§ЛьКЯЃЌЫљЕУШмвКжаЃКc(OHЃ)>c(Ba2ЃЋ)>c(NaЃЋ)>c(HЃЋ)
DЃЎЕШЮяжЪЕФСПХЈЖШЕФNaClOЁЂNaHCO3ЛьКЯШмвКжаЃКc(HClO)ЃЋc(ClOЃ)ЃНc(HCO![]() )ЃЋc(H2CO3)ЃЋc(CO
)ЃЋc(H2CO3)ЃЋc(CO![]() )
)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПБНМзЫсЙуЗКгІгУгкжЦвЉКЭЛЏЙЄаавЕЃЌФГЭЌбЇГЂЪдгУМзБНЕФбѕЛЏЗДгІжЦБИБНМзЫсЁЃ
ЂёЃЎжЦБИБНМзЫсКЭЛиЪеЮДЗДгІЕФМзБН
ЗДгІдРэЃК
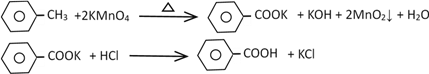
Ек1ВНЃКвЛЖЈСПЕФМзБНКЭKMnO4ШмвКдк100ЁцЗДгІвЛЖЮЪБМфКѓЭЃжЙЗДгІЃЛ
Ек2ВНЃКЙ§ТЫЗДгІЛьКЯЮяЃЌЕУЕНТЫвКЃЛОЙ§ВйзїЂёЃЌЕУЕНгаЛњВуКЭЫЎВуЃЛ
Ек3ВНЃКЯђгаЛњВужаМгЮоЫЎNa2SO4ЃЌЙ§ТЫЃЌОЙ§ВйзїЂђЃЌЕУЕНЮоЩЋвКЬхAЃЛ
Ек4ВНЃКЯђЫЎВуМгШыХЈбЮЫсЫсЛЏЃЌеєЗЂХЈЫѕЃЌРфШДЃЌЙ§ТЫЃЌЕУЕНАзЩЋЙЬЬхBЃЛ
вбжЊЃК
ЯрЖдЗжзгжЪСП | ШлЕу | ЗаЕу | УмЖШ | ШмНтЖШ | |
МзБН | 92 | Ѓ95Ёц | 110.8Ёц | 0.8669gЁЄmLЃ1 | МЋЮЂШмгкЫЎ |
БНМзЫс | 122 | 122.4Ёц | 249Ёц | 1.2659 gЁЄmLЃ1 | 0.3g (25ЁцЪБ) 6.9g (95ЁцЪБ) |
ЃЈ1ЃЉВйзїЂёЫљгУЕФВЃСЇвЧЦїгаЩеБКЭ______________ЃЌВйзїЂђЮЊ________________ЁЃ
ЃЈ2ЃЉЕк3ВНжаМгШыЮоЫЎNa2SO4ЕФФПЕФЪЧ_____________________ЃЌЮоЩЋвКЬхAЪЧ_______ЁЃ
ЂђЃЎЬсДПДжБНМзЫс
ИУЭЌбЇРћгУжиНсОЇЕФЗНЗЈЖдЕУЕНЕФBНјааЬсДПЁЃжиНсОЇЕФЙ§ГЬЃКМгШШШмНтЁњГУШШГщТЫЁњРфШДНсОЇЁњГщТЫЁњЯДЕгЁњИЩдяЁњДПБНМзЫсЁЃЃЈзЂЃКГщТЫзАжУШчЭМЫљЪОЃЌжївЊвЧЦїгаAВМЪЯТЉЖЗЃЌBГщТЫЦПЃЌГщЦјБУЕШЃЉ
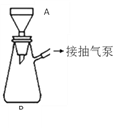
ЃЈ3ЃЉАзЩЋЙЬЬхBжаЕФдгжЪЪЧ____________ЁЃ
ЃЈ4ЃЉГУШШГщТЫЕУЕНЕФТЫвКЗХжУРфШДПЩвдНсОЇГіДПОЛЕФБНМзЫсОЇЬхЃЌЮЊСЫЕУЕНИќЖрЕФБНМзЫсЃЌЪЧВЛЪЧЮТЖШдНЕЭдНКУВЂЫЕУїРэгЩ______ЃЈЬюЁАЪЧЁБЛђЁАВЛЪЧЁБЃЉЃЌРэгЩ__________________________________________________________ЁЃ
ЃЈ5ЃЉЪЙгУГщТЫзАжУБШЦеЭЈЙ§ТЫзАжУЕФгХЕуЪЧ_______________________________________ЁЃ
ЃЈ6ЃЉЪЕбщжаШЁМзБН10.0 mLЃЌжЦЕУБНМзЫс8.0gЃЌБОДЮЪЕбщжаБНМзЫсЕФВњТЪЮЊ____________ЃЈНсЙћБЃСєЕНаЁЪ§ЕуКѓвЛЮЛЃЉЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПЯТСаЮяжЪжаЃЌМШКЌгаТШЗжзгЃЌгжКЌгаТШРызгЕФЪЧЃЈ ЃЉ
A.ТШЦјB.ТШЫЎC.бЮЫсD.ТШЛЏФЦ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПвдЯТЗЧН№ЪєбѕЛЏЮягыЦфв§Ц№ЕФЛЗОГЮЪЬтМАжївЊРДдДЖдгІе§ШЗЕФЪЧЃЈЁЁЁЁЃЉ
бѕЛЏЮя | ЛЗОГЮЪЬт | жївЊРДдД | |
A | CO2 | Ысгъ | ЛЏЪЏШМСЯЕФШМЩе |
B | CO | COжаЖО | ЦћГЕЮВЦјКЭЛЏЪЏШМСЯЕФВЛЭъШЋШМЩе |
C | NO2 | ЮТЪваЇгІ | ЙЄГЇЗЯЦјЕФХХЗХ |
D | SO2 | ЙтЛЏбЇбЬЮэ | ЦћГЕЮВЦјЕФХХЗХ |
A.A
B.B
C.C
D.D
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПCH4ЁЂCO2КЭЬМЫсЖМЪЧЬМЕФживЊЛЏКЯЮяЃЌЪЕЯжЬММАЦфЛЏКЯЮяЕФЯрЛЅзЊЛЏЃЌЖдПЊЗЂаТФмдДКЭНЕЕЭЬМХХЗХвтвхжиДѓЁЃ
ЃЈ1ЃЉвбжЊЃКЂйCH4(g)ЃЋH2O(g)![]() CO(g)ЃЋ3H2(g) ЁїH1ЃНЃЋ206.1kJmolЁЊ1
CO(g)ЃЋ3H2(g) ЁїH1ЃНЃЋ206.1kJmolЁЊ1
Ђк2H2(g)ЃЋCO(g)![]() CH3OH(l) ЁїH2ЃНЃ128.3kJmolЁЊ1
CH3OH(l) ЁїH2ЃНЃ128.3kJmolЁЊ1
Ђл2H2(g)ЃЋO2(g)ЃН2H2O(g) ЁїH3ЃНЃ483.6kJmolЁЊ1
аДГігЩМзЭщКЭбѕЦјКЯГЩвКЬЌМзДМЕФШШЛЏбЇЗНГЬЪНЃК_____________________ЁЃ
ЃЈ2ЃЉШєРћгУЗДгІЂйРДжЦБИЧтЦјЁЃЮЊСЫЬНОПЮТЖШЁЂбЙЧПЖдЗДгІЂйЕФгАЯьЃЌЩшМЦвдЯТШ§зщЖдБШЪЕбщЃЈЮТЖШЮЊ400ЁцЛђ500ЁцЃЌбЙЧПЮЊ101kPaЛђ404kPaЃЉЁЃ
ЪЕбщађКХ | ЮТЖШ/Ёц | бЙЧП/kPa | CH4ГѕЪМХЈЖШ/ molЁЄLЁЊ1 | H2OГѕЪМХЈЖШ/ molЁЄLЁЊ1 |
1 | 400 | 101 | 3.0 | 7.0 |
2 | T | 101 | 3.0 | 7.0 |
3 | 400 | P | 3.0 | 7.0 |
ЂёЁЂЪЕбщ1ЁЂЪЕбщ2КЭЪЕбщ3БШНЯЃЌЗДгІПЊЪМЪБе§ЗДгІЫйТЪзюПьЕФЪЧ_________ЃЛЦНКтЪБCH4ЕФзЊЛЏТЪзюаЁЕФЪЧ_________ЁЃ
ЂђЁЂЪЕбщ2КЭЪЕбщ3ЯрБШЃЌЦфЦНКтГЃЪ§ЙиЯЕЃКK2______K3ЃЈЬюЁАЃОЁБЁЂЁАЃМЁБЛђЁА=ЁБЃЉЁЃ
ЃЈ3ЃЉПЦбЇМвЬсГігЩCO2жЦШЁЬМЃЈCЃЉЕФЬЋбєФмЙЄвеШчЭМ1ЫљЪОЃЎ
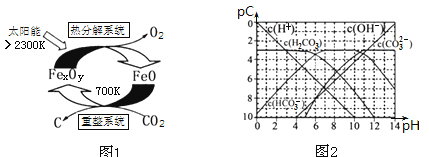
ЂйЁАжиећЯЕЭГЁБЗЂЩњЕФЗДгІжаn(FeO)ЁУn(CO2)ЃН6ЁУ1ЃЌдђFexOyЕФЛЏбЇЪНЮЊ______ЃЛ
ЂкЁАШШЗжНтЯЕЭГЁБжаУПЗжНтl mol FexOyЃЌЭЌЪБЩњГЩБъзМзДПіЯТЦјЬхЬхЛ§ЮЊ_______ЁЃ
ЃЈ4ЃЉpCРрЫЦpHЃЌЪЧжИМЋЯЁШмвКжаЕФШмжЪХЈЖШЕФГЃгУИКЖдЪ§жЕЁЃШчФГШмвКжаШмжЪЕФХЈЖШЮЊ1ЁС10ЁЊ2molLЁЊ1ЃЌдђИУШмвКжаШмжЪЕФpCЃНЉlg(1ЁС10ЁЊ2)ЃН2ЁЃЩЯЭМ2ЮЊ25ЁцЪБH2CO3ШмвКЕФpCЉpHЭМЁЃЧыЛиД№ЯТСаЮЪЬтЃК
Ђй
Ђкдк8ЃМpHЃМ10ЪБЃЌШмвКжаHCO3ЁЊЕФpCжЕВЛЫцзХpHдіДѓЖјМѕаЁЕФдвђЪЧ____ЃЛ
ЂлЧѓH2CO3вЛМЖЕчРыЦНКтГЃЪ§ЕФЪ§жЕKa1ЃН _______________ЁЃ
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com