
【题目】下列事实,不能用平衡移动原理解释的是( )
A.硫酸工业中,增大O2的浓度有利于提高SO2的转化率
B.将FeS固体投入到含有Cu2+的废水中以除去Cu2+
C.选择合适的催化剂可使水在较低温度下分解
D.滴有酚酞的CH3COONa溶液,加热后颜色变深
【答案】C
【解析】解:A.二氧化硫和氧气反应中存在平衡2SO2+O2 ![]() 2SO3 , 增大压强浓度平衡向正反应方向移动,所以有利于提高二氧化硫转化率,能用平衡移动原理解释,故A不选;
2SO3 , 增大压强浓度平衡向正反应方向移动,所以有利于提高二氧化硫转化率,能用平衡移动原理解释,故A不选;
B.FeS中存在溶解平衡FeS(s)Fe2++S2﹣ , CuS的溶度积常数小于FeS,将FeS固体投入到含有Cu2+的废水中以除去Cu2+ , 能将FeS转化为CuS,从而除去铜离子,所以能用平衡移动原理解释,故B不选;
C.催化剂只能改变反应速率不能改变平衡移动,所以不能用平衡移动原理解释,故C选;
D.醋酸钠中存在水解平衡CH3COO﹣+H2OCH3COOH+OH﹣ , 且盐类水解是吸热反应,升高温度促进水解,滴有酚酞的CH3COONa溶液,加热后颜色变深,所以可以用平衡移动原理解释,故D不选;
故选C.
【考点精析】通过灵活运用化学平衡移动原理以及影响因素,掌握影响因素:①浓度:增大反应物(或减小生成物)浓度,平衡向正反应方向移动;②压强:增大压强平衡向气体体积减小的方向移动.减小压强平衡向气体体积增大的方向移动;③温度:升高温度,平衡向吸热反应方向移动.降低温度,平衡向放热反应方向移动;④催化剂:不能影响平衡移动即可以解答此题.


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】下列说法不正确的是
A. 钠、铁和铜一样都能在氯气中燃烧生成金属氯化物。
B. 液氯是氯气的水溶液,它能使干燥的有色布条褪色。
C. 氯气跟变价金属反应生成高价金属氯化物。
D. 氯水具有杀菌、漂白作用是因为氯水中含有强氧化性的次氯酸。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 副族中没有非金属元素B. 原子最外层只有1个电子的元素一定是金属元素
C. 第VIIA族元素的最高化合价在数值上等于它所属的族序数D. 除短周期外,其他周期均有18种元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质中的杂质(括号中)可用加热的方法除去的是
A. Na2O2(Na2O) B. Na2O(Na2O2)
C. CO2(CO) D. KNO3(NaCl)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤制天然气工艺是煤高效洁净利用的新途径之一,其工艺流程简如图1如下: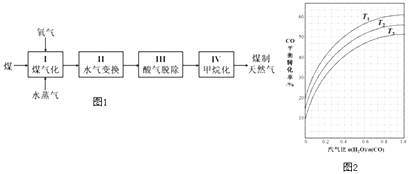
(1)反应I:C(s)+H2O(g)CO(g)+H2(g)△H=+135kJmol﹣1 , 通入的氧气会与部分碳发生燃烧反应.请利用能量转化及平衡移动原理说明通入氧气的作用: .
(2)反应II:CO(g)+H2O(g)CO2(g)+H2(g)△H=﹣41kJmol﹣1 . 如图2表示不同温度条件下,煤气化反应I发生后的汽气比(水蒸气与原料气中CO物质的量之比)与CO平衡转化率的变化关系.
①判断T1、T2和T3的大小关系: .
②若煤气化反应I发生后的汽气比为0.8,经煤气化反应I和水气变换反应II后,得到CO与H2的物质的量之比为1:3,则反应II应选择的温度是(填“T1”“T2”或“T3”).
(3)①甲烷化反应IV发生之前需要进行脱酸反应III.煤经反应I和II后的气体中含有两种酸性气体,分别是H2S和 .
②工业上常用热碳酸钾法脱除H2S气体得到两种酸式盐,该反应的化学方程式是 .
(4)已知:
CO(g)+H2O(g)CO2(g)+H2(g)△H1=﹣41kJmol﹣1
2H2(g)+O2(g)2H2O(g)△H2=﹣484kJmol﹣1
CH4(g)+2O2(g)CO2(g)+2H2O(g)△H3=﹣802kJmol﹣1
反应IV:CO(g)+3H2(g)CH4(g)+H2O(g)△H=
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为更好地表示溶液的酸碱性,科学家提出了酸度(AG)的概念:AG=1g ![]() ,则下列叙述不正确的是( )
,则下列叙述不正确的是( )
A.中性溶液的AG=0
B.碱性溶液的AG>0
C.AG越小碱性越强,酸性越弱
D.常温下0.1molL﹣1氢氧化钠溶液的AG=﹣12
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在化学研究中,往往可以通过观察现象认识物质变化的情况.请分析以下一组有现象变化的化学反应.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 饱和Na2SlO3溶液(含2滴酚酞) | 先滴加1.0mL0.5molL﹣1NaOH溶液:再滴加1.5mL1.0molL﹣1H2SO4溶液 | Ⅰ.红色溶液中出现胶状沉淀 |
0.1molL﹣1AlCl3溶液 | Ⅱ.加碱时 ;加酸时产生白色沉淀,又逐渐溶解直至消失 | ||
0.1molL﹣1Fe(NO3)2溶液 | Ⅲ.加碱时 ;加酸后溶液变为黄色 | ||
新制饱和氯水 | Ⅳ.加碱时溶液变为无色;加酸后无色溶液变为浅黄绿色 | ||
(1)用离子方程式解释现象I中出现胶状沉淀的原因: .
(2)II中加碱时出现的现象是 , 此现象说明溶液中发生反应的离子方程式是 .
(3)III中加碱时出现的现象是 .
(4)用离子方程式解释IV中加碱时出现的现象 .
(5)滴加试剂顺序的变化,会影响溶液中的现象和发生的反应,请继续分析以下实验.
实验 | 试剂及操作 | 现象 | |
试管 | 滴管 | ||
| 0.1 molL﹣1 Fe(NO3)2溶液 | 先滴加1.5 mL 1.0 molL﹣1 H2SO4溶液; | V.加酸时溶液无明显现象;加碱后溶液依然没有明显变化 |
①探究加酸时Fe(NO3)2溶液中是否发生了反应:
向1.0mL 0.1molL﹣1Fe(NO3)2溶液中 , 溶液立即变红,说明溶液中含Fe3+ , 证明加酸时溶液中发生了反应.
②推测溶液中产生Fe3+的可能原因有两种:
a.酸性条件下,0.1molL﹣1 Fe(NO3)2溶液中的Fe2+被NO3﹣氧化;
b.(用离子方程式表示).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学--选修3:物质结构与性质]东晋《华阳国志南中志》卷四中已有关于白铜的记载,云南镍白铜(铜镍合金)闻名中外,曾主要用于造币,亦可用于制作仿银饰品.回答下列问题:
(1)镍元素基态原子的电子排布式为 , 3d能级上的未成对电子数为 .
(2)硫酸镍溶于氨水形成[Ni(NH3)6]SO4蓝色溶液.
①[Ni(NH3)6]SO4中阴离子的立体构型是 .
②在[Ni(NH3)6]SO4中Ni2+与NH3之间形成的化学键称为 , 提供孤电子对的成键原子是 .
③氨的沸点(填“高于”或“低于”)膦(PH3),原因是;氨是分子(填“极性”或“非极性”),中心原子的轨道杂化类型为 .
(3)单质铜及镍都是由键形成的晶体;元素铜与镍的第二电离能分别为:ICu=1 958kJmol﹣1、INi=1 753kJmol﹣1 , ICu>INi的原因是 .
(4)某镍白铜合金的立方晶胞结构如图所示.
①晶胞中铜原子与镍原子的数量比为 .
②若合金的密度为d gcm﹣3 , 晶胞参数a=nm.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有MgCl2、Al2(SO4)3的混合溶液,向其中不断加入NaOH溶液,得到的沉淀量与加入的NaOH溶液的关系如图所示,则溶液中c(Cl)与c(SO42)之比为( ) 
A.1:1
B.2:3
C.3:2
D.2:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com