
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的沸点:Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
【答案】C
【解析】
试题分析:根据题意可知:X是N;Y是O;Z是Al;W是S;Q是Cl。A.由于O元素的原子半径小,获得电子的能力强,所以元素Y的最高正化合价不等于原子的最外层电子数,错误;B.对于电子层结构不同的元素说,元素离子的核外电子层数越多,离子半径就越大;对于电子层结构相同的元素说,核电荷数越大,离子半径就越小。所以离子半径的大小顺序为W>Q >X>Y >Z,错误;C.元素的非金属性越强,去气态氢化物的稳定性就越强,由于元素的非金属性Y>W,所以气态氢化物的沸点:Y>W,正确;D.元素的非金属性越强,其对应的最高价氧化物对应的水化物的酸性就越强。元素的非金属性Q>W,所以元素Q的最高价氧化物对应的水化物酸性比W的强,错误。
考点:考查元素周期表、元素周期律的知识。


科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
对热化学方程式C(s)+H2O(g)═CO(g)+H2(g)△H=+131.3kJ•mol﹣1最准确的理解是( )
A.碳和水反应吸收131.3 kJ热量
B.1 mol碳和1 mol水反应生成一氧化碳和氢气,同时放出131.3 kJ热量
C.1 mol碳和1 mol水蒸气反应生成1 mol CO和1 mol H2,同时吸收131.3 kJ热量
D.1个固态碳原子和1分子水蒸气反应吸热131.1 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
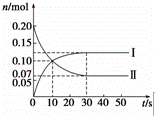
(1)在容积为2L的密闭容器中,保持体系内温度800℃不变,将一定量的NO和O2混合发生反应:2NO+O2⇌2NO2,其中NO的物质的量(n)随时间(t)的变化关系如图所示.请回答下列问题.
①图象中曲线 Ⅰ (选填“Ⅰ”或“Ⅱ”)表示NO2的变化.
②若升高反应体系的温度,使反应重新达到平衡,此时体系中n(NO)=n(NO2),则该反应是 放 热反应(选填“吸”或“放”).
③在800℃时,若缩小容器的体积,达新平衡时n(NO) < (选填“>”、“=”或“<”)0.07mol,NO的转化率 增大 (选填“增大”、“不变”或“减小”).
(2)一定条件下,体积为1L的密闭容器中发生如下反应:SiF4(g)+2H2O(g)⇌SiO2(s)
+4HF(g)△H=+148.9kJ•mol﹣1.
①下列各项中能说明该反应已达化学平衡状态的是 bcd (填字母序号).
a.v消耗(SiF4)=4v生成(HF)
b.容器内气体压强不再变化
c.容器内气体的总质量不再变化
d.HF的体积分数不再变化
②反应过程中测定的部分数据如下表(表中t2>t1)所示.通过a或b的值及化学平衡原理判断t1时反应是否达到化学平衡状态: t1时反应已经达到化学平衡状态 .
| 反应时间/min | n(SiF4)/mol | n(H2O)/mol |
| 0 | 1.20 | 2.40[ |
| t1 | 0.80 | a |
| t2 | b | 1.60 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
25℃时,下列有关溶液中微粒的物质的量浓度关系不正确的是
A.0.1 mol·L-1 (NH4)2Fe(SO4)2溶液中:c(SO42-)>c(NH4+)>c(Fe2+)>c(H+)
B.pH =11的氨水和pH=3的盐酸溶液等体积混合,所得溶液中:c(Cl-)>c(NH4+)> c(OH-)>c(H+)
C.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH) = 0.1 mol·L-1
D.0.1 mol·L-1的醋酸钠溶液20 mL与0.1 mol·L-1盐酸10 mL混合后溶液显酸性 c(CH3COO-)>c(Cl-)
>c(CH3COOH)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
慢心律是一种治疗心律失常的药物,它的合成路线如下:
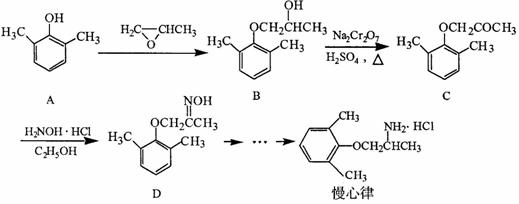
(1)由B → C的反应类型为 。
(2)B分子中有2个含氧官能团,分别为 和 (填官能团名称)。
(3)写出A与浓溴水反应的化学方程式 。
(4)写出同时满足下列条件的D的一种同分异构体的结构简式: 。
①属于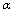 -氨基酸;
-氨基酸;
②是苯的衍生物,且苯环上的一氯代物只有一种。
(5)已知乙烯在催化剂作用下与氧气反应可以生成环氧乙烷。
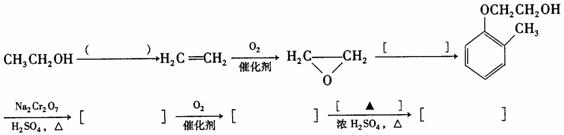
完成以邻甲基苯酚(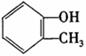 )和乙醇为原料制备
)和乙醇为原料制备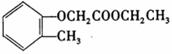 的合成路线流程图。
的合成路线流程图。
①结合题中信息;无机试剂任用。
②合成路线流程图中,在( )填反应条件,在[ ]填反应物或生成物的结构简式:
查看答案和解析>>
科目:高中化学 来源: 题型:
乱扔废旧电池会导致严重的环境污染,一节废电池就是一颗“炸弹”。某同学用废干电池内的黑色固体(可能含有MnO2、NH4Cl、ZnCl2等物质)进行如下实验:
黑色固体 溶解
溶解 过滤
过滤 固体灼烧
固体灼烧
(1)上述三步操作中都用到的一种玻璃仪器是________________。
(2)将灼烧后的固体移入试管,滴加双氧水,能迅速产生一种使余烬的木条复燃的气体,由此推断黑色固体中含有MnO2,它在该反应中的作用为____________。MnO2有一定的氧化性,请写出一个MnO2作氧化剂的反应的化学方程式:______________________________。
(3)验证步骤②的滤液中含有NH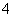 ,下面是某一实验方案记录片段.请填写下列空白:
,下面是某一实验方案记录片段.请填写下列空白:
实验过程:________________________________________________________。
实验现象:有刺激性气味的气体产生。
写出该实验中反应的离子方程式:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列是某同学对KHSO4的物质类型进行的分析,其中不正确的是( )
A.根据元素组成知它是化合物
B.因它含有钾与硫酸根,故KHSO4是钾盐
C.KHSO4可以称为硫酸盐
D.因为它含有与酸相同的元素氢,故KHSO4也可称为酸
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com