
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)斜长石(KAlSi3O8)和NaCl熔浸可制得KCl,原理是:
NaCl(l) + KAlSi3O8(s) KCl(l)+ NaAlSi3O8(s)。
KCl(l)+ NaAlSi3O8(s)。
①. 斜长石含有的化学键类型有_________________。
②. 上述反应涉及的元素原子中,半径最大的是 ,它和氢元素形成的化合物的电子式为 __________。
(2)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓由
大到小的顺序为 。
(3)亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
①.往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式:
。
② .碲酸(H6TeO6)氧化性比浓硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: HI+ H6TeO6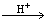 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
若反应中生成的TeO2与Te的物质的量之比为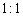 ,试配平上述化学方程式。
,试配平上述化学方程式。
已知Cu(OH)2 能溶解在足量的氨水中,则其离子反应方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
已知:①N2(g)+O2(g)═2NO(g)△H1=+180kJ•mol﹣1
②N2(g)+3H2(g)⇌2NH3(g)△H2=﹣92.4kJ•mol﹣1
③2H2(g)+O2(g)═2H2O(g)△H3=﹣483.6kJ•mol﹣1
下列说法正确的是( )
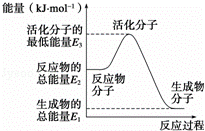
|
| A. | 反应②中的能量变化如图所示,则△H2=E1﹣E3 |
|
| B. | H2的燃烧热为241.8 kJ•mol﹣1 |
|
| C. | 由反应②知在温度一定的条件下,在一恒容密闭容器中通入1 mol N2和3 mol H2,反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2充分反应后放出的热量为Q2 kJ,则184.8>Q2>2Q1 |
|
| D. | 氨的催化氧化反应为4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=+906 kJ•mol﹣1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
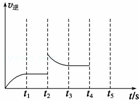
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期主族元素X、Y、Z、W、Q的原子序数依次增大。X的气态氢化物极易溶于Y的氢化物中,常温下,Z的块状单质能溶于W的最高价氧化物的水化物的稀溶液,却不溶于其浓溶液。下列说法正确的是
A.元素Y的最高正化合价为+6
B.离子半径的大小顺序为W>Q>Z>X>Y
C.气态氢化物的沸点:Y>W
D.元素W的最高价氧化物对应的水化物酸性比Q的强
查看答案和解析>>
科目:高中化学 来源: 题型:
将含镁、钾的盐湖水蒸发,最后得到的产物中含光卤石(xKCl·yMgCl2·zH2O)。它在空气中极易潮解,易溶于水,是制造钾肥和提取金属镁的重要原料,其组成可通过下列实验测定。
①准确称取5.550 g样品溶于水,配成100 mL溶液。
②将溶液分成二等份,在一份中加入足量的NaOH溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.580 g。
③在另一份溶液中加入足量的硝酸酸化的AgNO3溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体4.305 g。
(1)步骤②中检验白色固体已洗净的方法是 。
(2)已知某温度下Mg(OH)2的Ksp = 6.4×10-12,当溶液中c(Mg2+)≤1.0×10-5 mol·L-1 可视为沉淀完全,则应保持溶液的OH-的浓度≥ mol·L-1 。
(3)通过计算确定样品的组成(写出计算过程)。
查看答案和解析>>
科目:高中化学 来源: 题型:
生活中难免会遇到一些突发事件,我们要善于利用学过的知识,采取科学、有效的方法保护自己。如果发生了氯气泄漏,以下自救方法得当的是( )
A.只要在室内放一盆水 B.向地势低的地方撤离
C.观察风向,顺风撤离 D.用湿毛巾或蘸有纯碱水的毛巾捂住口鼻撤离
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com