
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
【知识点】氧化还原反应的有关概念B2 B3
【答案解析】D 解析:根据方程式,氧化产物和还原产物都是氮气,假设氧化产物有15摩尔,则还原产物有1摩尔,
10NaN3+2KNO3= K2O+5Na2O+15N2↑(氧化产物)+1N2↑(还原产物) △n
15 1 14
X y 1.75
解得:x=1.875 y=0.125
A、生成N2标准状况下的体积是(1.875+0.125)mol×22.4L/mol=44.8L,故A错误;B、KNO3被还原,故B错误;C、转移电子的物质的量为0.125×2×5=1.25mol ,故C错误;D、被氧化的N原子的物质的量为1.875mol×2=3.75mol,故D正确。
故答案选D
【思路点拨】本题考查了氧化还原反应的有关概念,氧化产物和还原产物都是氮气,关键是找到氧化产物和还原产物的关系。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
在t℃下,某反应达到平衡,平衡常数K=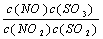 。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
。恒容时,温度升高,NO浓度减小。下列说法正确的是 ( )
A.该反应的焓变为正值 B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度
C.升高温度,逆反应速率减小 D.该反应化学方程式为:NO+SO3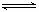 NO2+SO2
NO2+SO2
查看答案和解析>>
科目:高中化学 来源: 题型:
使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是 ( )
A.在燃煤中添加生石灰 B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层 C.用多孔吸附剂清除水面油污
查看答案和解析>>
科目:高中化学 来源: 题型:
天然气化工是指通过甲烷的化学反应来生产一系列化工产品的工艺过程。以天然气为原料经下列反应路线可得工程塑料PBT。
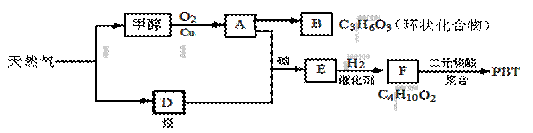
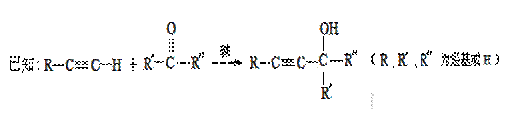
(1)B分子结构中只有一种氢、一种氧、一种碳,则B的结构简式是 ;B的同分异构体中与葡萄糖具有类似结构的是 。(写结构简式)
(2)F的结构简式是 ;PBT属于 类有机高分子化合物。
(3)由A、D生成E的反应方程式为 ,其反应类型为 。
(4)E的同分异构体G不能发生银镜反应,能使溴水褪色,能水解且产物的碳原子数不等,则G在NaOH溶液中发生水解反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机化合物的结构简式为: ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
A. 1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2型分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g/L; W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是
A.原子半径: W>Z>Y>X>M B.XZ2、X2M2、W2Z2均为直线形的共价化合物
C.由X元素形成的单质不一定是导体
D.由 X、Y、Z、M四种元素形成的化合物一定既含有离子键,又含有共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
已知: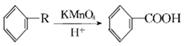 ,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
,从A出发发生图示中的一系列反应,其中B和C按1:2反应生成Z,F和E按1:2反应生成W,W和Z互为同分异构体。
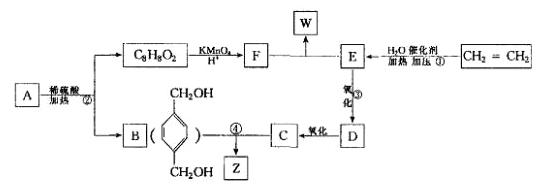
回答下列问题:
(1)写出反应类型:①_____________________,②______________________________。
(2)写出下列反应的化学方程式:
③_____________________________________________________;
④_____________________________________________________。
(3)与B互为同分异构体,属于酚类且苯环上只有两个互为对位取代基的化合物有4种,其结构简式为_______________,_________________,_______________,______________。
(4)A的结构简式可能为_______________________________________(只写一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
聚合氯化铝是一种新型净水剂,其中铝的总浓度(用AlT表示)包括三类‘“主要为Al3+的单体形态铝总浓度(用Ala表示);主要为[AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝总浓度(用A1c表示)。
(1)一定条件下,向1.0 mol/LAlCl3溶液中加入0.6 mol/L的NaOH溶液,可制得Alb含量约为86%的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_____________________。
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝中铝形态分布(百分数)如下表:
| AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
| 0.208 | 1.4 | 86.6 | 12.0 |
| 0.489 | 2.3 | 86.2 | 11.5 |
| 0.884 | 2.3 | 88.1 | 9.6 |
| 1.613 | 3.1 | 87.0 | 9.9 |
| 2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,pH (填“越大”、“越小”或“不变”)。
②如将AlT = 2.520 mol·L-1的聚合氯化铝溶液加水稀释,则稀释过程中主要发生反应的离子方程式: 。
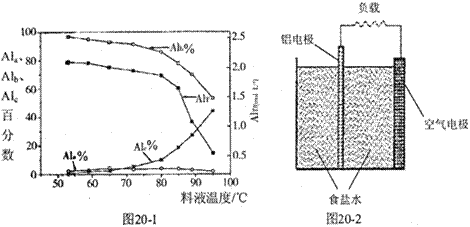
③膜蒸馏料液温度对铝聚合形态百分数及铝的总浓度的影响如图20—1。当T>80℃时,AlT显著下降的原因是 。
(3)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s) = 3AlCl(g)+3CO(g) △H1 = a kJ·mol-1
②3AlCl(g) = 2Al(l)+ AlCl3(g) △H2 = b kJ·mol-1
则反应Al2O3(s)+ 3C(s) = 2Al(l)+ +3CO(g) △H = kJ·mol-1(用含a、b的代数式表示)。反应①常压下在1900℃的高温下才能进行,说明△H 0(填“>”“=”或“<”)。
(4)一种铝空气电池结构如图20-2所示,写出该电池正极的电极反应式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质性质与应用对应关系正确的是
A.漂白粉在空气中不稳定,可用于漂白纸张
B.医用酒精能使蛋白质变性,可用于消毒杀菌
C.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
D.铜的金属活泼性比铁的弱,可在铁闸上装若干铜块以减缓其腐蚀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com