
使用化学手段可以消除某些环境污染。下列主要依靠化学手段消除环境污染的是 ( )
A.在燃煤中添加生石灰 B.将某些废旧塑料融化后再成型
C.把放射性核废料深埋于地下岩层 C.用多孔吸附剂清除水面油污
【知识点】物理变化与化学变化、常见化学污染与环境O1
【答案解析】A 解析:A.生石灰能和氧气、煤燃烧生成的二氧化硫等物质反应生成硫酸钙,属于化学变化,故A正确;B.将某些废旧塑料融化后再成型的过程中没有新物质生成,属于物理变化,故B错误;C.把放射性核废料深埋于地下岩层的过程中没有新物质生成,属于物理变化,故C错误;D.用多孔吸附剂清除水面油污的过程中没有新物质生成,属于物理变化,故D错误.
故答案选A
【思路点拨】本题考查化学变化与物理变化的区别和联系,难度不大,解答本题要分析变化过程中是否有新物质生成,如果没有新物质生成就属于物理变化,如果有新物质生成就属于化学变化 。


科目:高中化学 来源: 题型:
下列有关物质分类或归纳不正确的是
①电解质:明矾、冰醋酸、氯化银、纯碱 ②化合物:BaCl2、Ca(OH)2、HNO3、HT
③混合物:盐酸、漂白粉、水玻璃、水银 ④同素异形体:金刚石、石墨、C60、C70
A.①② B.②③ C.③④ D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2+3H22NH3是工业上合成氨的重要反应。
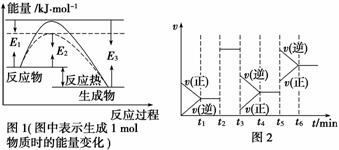
(1)根据图1请写出合成氨的热化学方 程式__________________________________(热量用E1、E2或E3表示)。
程式__________________________________(热量用E1、E2或E3表示)。
(2)图1中虚线部分是通过改变化学反应中的________条件,该条件的改变与图2中哪一时刻条件的改变相同________(用“t1~t6”表示)。
(3)t3时刻改变的条件是____________, t5时刻改变的条件是____________。
t5时刻改变的条件是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有机物X的结构如下,下列说法正确的是
A. X能发生氧化、取代、酯化、加聚、缩聚反应
B. X与FeCl3溶液不能发生显色反应
C. 1mol X与足量NaOH溶液反应,最多消耗2mol NaOH
D. X的分子式为C23H26 N2O7
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
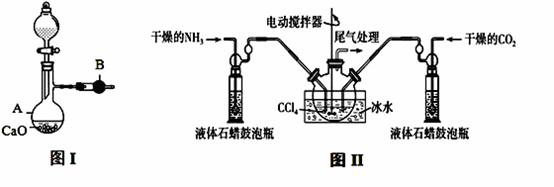
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。
请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各组离子在给定条件下能大量共存的是 ( )
A.在c(HCO3-)=0.1 mol·L-1的溶液中:NH4+、Al3+、Cl-、NO3-
B.有大量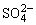 存在的溶液中:Na+、Mg2+、Ca2+、I-
存在的溶液中:Na+、Mg2+、Ca2+、I-
C.有大量 存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
存在的强酸性溶液中:NH4+、Ba2+、Fe2+、Br-
D.能使红色石蕊试纸变蓝的溶液中:SO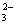 、S2-、Na+、K+
、S2-、Na+、K+
查看答案和解析>>
科目:高中化学 来源: 题型:
某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
A.1:1 B.1:2 C.1: 3 D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)斜长石(KAlSi3O8)和NaCl熔浸可制得KCl,原理是:
NaCl(l) + KAlSi3O8(s) KCl(l)+ NaAlSi3O8(s)。
KCl(l)+ NaAlSi3O8(s)。
①. 斜长石含有的化学键类型有_________________。
②. 上述反应涉及的元素原子中,半径最大的是 ,它和氢元素形成的化合物的电子式为 __________。
(2)常温下,pH=3的HCOOH溶液与pH=11的NaOH溶液等体积混合后,溶液中离子浓由
大到小的顺序为 。
(3)亚硒酸(H2SeO3)也是一种二元弱酸,常温下是一种无色固体,易溶于水,有较强的氧化性。
①.往亚硒酸溶液中不断通入SO2 会产生红褐色单质,写出该反应的化学方程式:
。
② .碲酸(H6TeO6)氧化性比浓硫酸还要强。在酸性介质中,碲酸可将HI氧化成I2,方程式如下: HI+ H6TeO6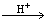 TeO2+ Te+ I2+ H2O
TeO2+ Te+ I2+ H2O
若反应中生成的TeO2与Te的物质的量之比为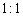 ,试配平上述化学方程式。
,试配平上述化学方程式。
已知Cu(OH)2 能溶解在足量的氨水中,则其离子反应方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com