
某有机化合物的结构简式为: ,下列有关该物质的叙述正确的是
,下列有关该物质的叙述正确的是
A. 1 mol该物质最多可以消耗3 mol Na
B.1 mol该物质最多可以消耗7 mol NaOH
C.不能与Na2CO3溶液反应
D.易溶于水,可以发生加成反应和取代反应
科目:高中化学 来源: 题型:
下列叙述中,不正确的是
A.某特定反应的平衡常数仅是温度的函数 B.催化剂不能改变平衡常数的大小
C.平衡常数发生变化,化学平衡不一定发生移动 D.化学平衡发生移动,平衡常数不一定发生变化
查看答案和解析>>
科目:高中化学 来源: 题型:
氨基甲酸铵(NH2COONH4)是一种白色固体,可用做肥料、灭火剂、洗 涤剂等。制备氨基甲酸铵的化学方程式如下:2NH3(g)+CO2(g) NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
NH2COONH4(s) ΔH < 0,已知氨基甲酸铵有以下性质:
a.常温下在干燥的空气中稳定,遇水生成碳酸铵或碳酸氢铵;
b. 59℃则可分解成NH3和CO2气体;
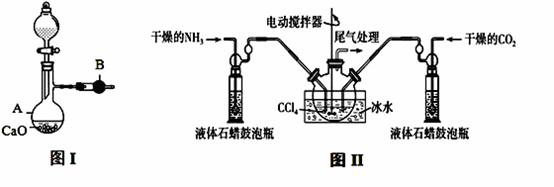
用如图I装置制备干燥的氨气,图II装置制备氨基甲酸铵,把制备的干燥的氨气和二氧化碳通入四氯化碳中不断搅拌混合,当生成的氨基甲酸铵晶体悬浮在四氯化碳中较多时停止制备(注:四氯化碳与液体石蜡均为惰性介质)。
请回答下列问题:
(1)图I中,仪器B的名称 , A中的化学反应方程式是 ;
(2)图II装置中使用冰水的原因是 ;
(3)图II中液体石蜡鼓泡瓶的作用是 ;
(4)从图II反应后的混合物中分离出产品的方法是 ;
 A.蒸馏 B.过滤 C.分液 D.结晶
A.蒸馏 B.过滤 C.分液 D.结晶
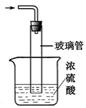
(5)图II装置中,尾气处理装置如右图所示,玻璃管的作用 ,浓硫酸的作用是 和防止空气中水蒸气进入反应器使氨基甲酸铵水解;
(6)取因部分变质而混有碳酸氢铵的氨基甲酸铵样品7.82 g,用足量石灰水充分处理后,使碳元素完全转化为碳酸钙,过滤、洗涤、干燥,测得质量为10.0 g,则样品中氨基甲酸铵的质量分数为 (计算结果精确至0.1%)
查看答案和解析>>
科目:高中化学 来源: 题型:
某二价金属的碳酸盐和酸式碳酸盐的混合物,跟足量的稀盐酸反应,消耗H+和生成CO2物质的量之比为6:5,则该混合物中碳酸盐和酸式碳酸盐的物质的量之比是 ( )
A.1:1 B.1:2 C.1: 3 D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
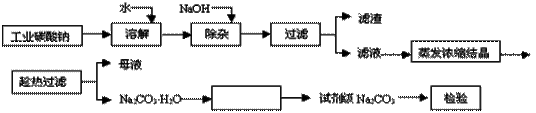
碳酸钠是造纸、玻璃、纺织、制革等行业的重要原料。工业碳酸钠(纯度约98%)中含有Ca2+、Mg2+、Fe3+、Cl-和SO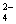 等杂质,提纯工艺路线如下:
等杂质,提纯工艺路线如下:
已知碳酸钠的溶解度(S)随温度变化的曲线如图所示:

回答下列问题:
(1)滤渣的主要成分为_________________________。
(2)“趁热过滤”的原因是______________________。
(3)在实验室做Na2CO3·H2O脱水实验,判断其脱水完全的方法是:__________。
(4)生产过程中“母液”____(填“能”或“不能”)循环使用。若不能,其原因是:_________。
(5)已知:Na2CO3·10H2O(s)=Na2CO3(s)+10H2O(g);ΔH1= +532.36 kJ·mol-1
Na2CO3·10H2O(s)=Na2CO3·H2O(s)+9H2O(g);ΔH2= +473.63 kJ·mol-1
写出Na2CO3·H2O脱水反应的热化学方程式_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
汽车剧烈碰撞时,安全气囊中发生反应:10NaN3+2KNO3= K2O+5Na2O+16N2↑。若氧化产物比还原产物多1. 75 mol,则下列判断正确的是
A.生成40.0 L N2(标准状况) B.有0. 250 mol KNO3被氧化
C.转移电子的物质的量为1. 75mol D.被氧化的N原子的物质的量为3.75mol
查看答案和解析>>
科目:高中化学 来源: 题型:
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为
A. 66.4 g B.50.8 g C 44.8g D. 39.2 g
查看答案和解析>>
科目:高中化学 来源: 题型:
葛根素具有降血压等作用,其结构简式如下图,下列有关说法正确的是
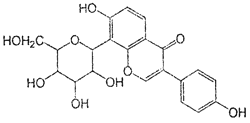
A.该物质在一定条件下能发生消去反应、加成反应、取代反应
B.葛根素的分子式为C21H22O9
C.该物质一个分子中含有5个手性碳原子
D.一定条件下1 mol 该物质与H2反应最多能消耗7 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
已知合成氨的反应为N2(g)+3H2(g)⇌2NH3(g)△H=﹣92.4 kJ•mol﹣1.
Ⅰ.在体积为5L的恒温、恒容密闭容器甲中,起始时投入2mol N2、3mol H2,经过10s达到平衡,测得平衡时NH3的物质的量为0.8mol.
Ⅱ.在容器乙中,起始时投入3mol N2、b mol H2,维持恒温、恒压达到平衡,测得平衡时NH3的物质的量为1.2mol.此时与容器甲中平衡状态温度相同,相同组分的体积分数都相同.
(1)容器甲10s内用H2表示的平均反应速率v(H2)= 0.024mol•L﹣1•s﹣1 ,达平衡时N2的转化率= 20% .
(2)甲容器中反应的逆反应速率随时间变化的关系如图.t2时改变了某一种条件,改变的条件可能是 升高了温度 、 增大了氨的浓度 (填写两项).
(3)下列哪些情况表明容器乙已达平衡状态 ACD (填字母).
A.容器乙中的气体密度不再变化
B.氨气的生成速率等于氮气的消耗速率的2倍
C.断裂1mol N≡N键同时断裂6mol N﹣H键
D.容器乙中气体的平均相对分子质量不随时间而变化.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com