
 ,分子空间构型为平面正六边形,
,分子空间构型为平面正六边形, ;平面正六边形;
;平面正六边形;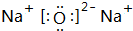 和
和 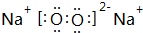 ,
,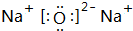 ;
; ;
;| 酒化酶 |
| 酒化酶 |
| 点燃 |
| Cu |
| △ |
| 点燃 |
| Cu |
| △ |


 小学期末标准试卷系列答案
小学期末标准试卷系列答案科目:高中化学 来源: 题型:
| A、标准状况下,1摩尔甲醇的体积约为22.4L |
| B、1摩尔庚烷中含有的共用电子对数为23摩尔 |
| C、1摩尔氢氧根离子(OH-)与羟基(-OH)所含电子数均为10NA |
| D、2.8 g乙烯与丙烯的混合物中含总原子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、2.7 g 金属铝所含电子数目为0.3N |
| B、16 g CH4所含原子数目NA |
| C、17 g NH3所含电子数目为NA |
| D、18 g 水所含分子数目为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(B) |
| c(C) |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图装置闭合电键时,电流计A的指针将发生偏转.试回答下列问题.
如图装置闭合电键时,电流计A的指针将发生偏转.试回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.
甲醇(CH3OH)是基本有机原料之一,是制造农药、医药、塑料、合成纤维及其他产品如甲醛、甲胺、氯甲烷、硫酸二甲酯等的原料.查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
| A、放电时正极反应为:FeO42-+4H2O+3e-═Fe(OH)3+5OH- |
| B、充电时阴极反应为:Zn(OH)2+2e-═Zn+2OH- |
| C、放电时每转移3mol电子,正极有1mol K2FeO4被氧化 |
| D、充电时阳极附近溶液的pH减小 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com