
【题目】工业排放的对苯二甲酸回收困难,经研究采用ZnO为催化剂,催化脱羧制备苯,脱羧反应机理如下。下列说法中不正确的是
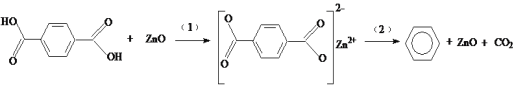
A.过程(1)中断开O—H键需要吸收能量
B.过程(2)中断开C—C键,形成C—H键
C.对苯二甲酸在脱羧反应中被还原为苯
D.ZnO能降低对苯二甲酸脱羧反应的焓
 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32— =CO2↑+ H2O
B.用氢氧化钠检验氯化铵溶液中铵根离子:NH4+ + OH-![]() NH3 ↑+ H2O
NH3 ↑+ H2O
C.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42—=BaSO4↓
D.氯气与NaOH溶液反应:Cl2 + OH-= Cl- + ClO- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水中溶氧量(DO)是衡量水体自净能力的一个指标,通常用每升水中溶解氧分子的质量表示,单位mg/L,我国《地表水环境质量标准》规定,生活饮用水源的DO不能低于5mg/L。某化学小组同学设计了下列装置(夹持装置略),测定某河水的DO。

1、测定原理:
碱性条件下,O2将Mn2+氧化为MnO(OH)2:①2Mn2++O2+4OH="2" MnO(OH)2↓
酸性条件下,MnO(OH)2将I氧化为I2:②MnO(OH)2+I+H+→Mn2++I2+H2O(未配平),用Na2S2O3标准溶液滴定生成的I2:③2S2O32+I2=S4O62+2I
2、测定步骤
a.安装装置,检验气密性,充N2排尽空气后,停止充N2。
b.向烧瓶中加入200mL水样。
c.向烧瓶中依次迅速加入1mLMnSO4无氧溶液(过量)、2mL碱性KI无氧溶液(过量),开启搅拌器,至反应①完全。
d搅拌并向烧瓶中加入2mL硫酸无氧溶液至反应②完全,溶液为中性或弱酸性。
e.从烧瓶中取出40.00mL溶液,以淀粉作指示剂,用0.01000mol/L Na2S2O3溶液进行滴定,记录数据。
f.……
g.处理数据(忽略氧气从水样中的逸出量和加入试剂后水样体积的变化)。
回答下列问题:
(1)配置以上无氧溶液时,除去所用溶剂水中氧的简单操作为__________。
(2)在橡胶塞处加入水样及有关试剂应选择的仪器为__________。
①滴定管②注射器③量筒
(3)搅拌的作用是__________。
(4)配平反应②的方程式,其化学计量数依次为__________。
(5)步骤f为__________。
(6)步骤e中达到滴定终点的标志为__________。若某次滴定消耗Na2S2O3溶液4.50mL,水样的DO=__________mg/L(保留一位小数)。作为饮用水源,此次测得DO是否达标:__________(填“是”或“否”)
(7)步骤d中加入硫酸溶液反应后,若溶液pH过低,滴定时会产生明显的误差,写出产生此误差的原因(用离子方程式表示,至少写出2个)__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项比较中,一定相等的是
A.等物质的量的OH-和-OH中所含电子数
B.等质量的氧气和臭氧中含有的氧原子数目
C.1molNa2O2固体中阳离子与阴离子的数目
D.等物质的量的Cu与Fe分别与足量的稀硝酸反应时转移的电子数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由下列实验及现象推出相应结论正确的是
选项 | 实验 | 现象 | 结论 |
A | 某溶液中加入Ba(NO3)2溶液,再加足量盐酸 | 先有白色沉淀生成,加盐酸后白色沉淀不消失 | 原溶液中有SO42- |
B | 将湿润的淀粉碘化钾试纸放在盛有红棕色气体的集气瓶口 | 试纸变蓝 | 红棕色气体为溴蒸气 |
C | 将碳酸钠与盐酸反应产生的气体通入盛有硅酸钠溶液的烧杯中 | 烧杯中液体变浑浊 | 非金属性:Cl>C>Si |
D | 将0.1mol/LMgSO4溶液滴入NaOH溶液至不再有沉淀产生,再滴加0.1mol/LCuSO4溶液 | 先有白色沉淀生成,后转变为蓝色沉淀 | 溶解度:Cu(OH)2<Mg(OH)2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙二酸(H2C2O4)俗称草酸,为无色晶体,是二元弱酸,其电离常数Ka1=5.4×10![]() ,Ka2=5.4×10
,Ka2=5.4×10![]() 。回答下列问题:
。回答下列问题:
(1)向10 mL0.1mol·L![]() H2C2O4溶液中逐滴加入0.1mol·L
H2C2O4溶液中逐滴加入0.1mol·L![]() NaOH溶液
NaOH溶液
①当溶液中c(Na+)=2c(C2O42-)+c(HC2O4-)时,加入V(NaOH)___________10 mL(填“>”“=”或“<”)。
②随着苛性钠的加入,H+逐渐减少,当溶液中含碳粒子的主要存在形态为C2O42-时,溶液的酸碱性为____________(填标号)。
A.强酸性 B.弱酸性 C.中性 D.碱性
(2)某同学设计实验测定含杂质的草酸晶体(H2C2O4·2H2O)纯度(杂质不与酸性高锰酸钾反应)。实验过程如下:称取m g草酸晶体于试管中,加水完全溶解,用c mol·L![]() KMnO4标准溶液进行滴定
KMnO4标准溶液进行滴定
①通常高锰酸钾需要酸化才能进行实验,通常用_________酸化
A.硫酸 B.盐酸 C.硝酸 D.石炭酸
②则达到滴定终点时的现象是_____________________;
③该过程中发生反应的离子方程式为___________________________;
④滴定过程中消耗V mL KMnO4标准溶液,草酸晶体纯度为_________________。
(3)医学研究表明,肾结石主要是由CaC2O4 组成的,已知Ksp(CaC2O4)=2.3×10-9,若血液经血小球过滤后,形成的尿液为200 mL,其中含有Ca2+ 0.01 g。为了不形成CaC2O4 沉淀,则C2O42-的最高浓度为______ mol·L![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知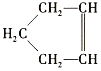 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为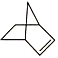 。
。
(1)降冰片烯属于(___________)(填序号)
A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为__。
(3)降冰片烯不具有的性质是(___________)(填序号)
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Cl2+2I=2C1-+I2为验证Fe3+、I2氧化性的相对强弱。某小组用如图所示装置进行实验(夹持仪器已略去,气密性已检验)。

实验过程:
Ⅰ.打开弹簧夹,打开活塞a,滴加浓盐酸。
Ⅱ.当B和C中的溶液都变为黄色时,夹紧弹簧夹。
Ⅲ.向B中加入一定量KSCN溶液,混合液显红色,关闭活塞a。
Ⅳ.打开活塞b,将C中的溶液滴入D中,关闭活塞b,取下D振荡、静置。
请回答下列问题:
(1)A中产生黄绿色气体,写出A中发生反应的离子方程式___。
(2)验证氯气的氧化性强于碘单质的实验现象是___。
(3)B中通入氯气溶液变黄的离子方程式是;再向B中滴加KSCN溶液,溶液变红的离子方程式是___。
(4)C中的溶液滴入D中,振荡、静置,若产生现象,则说明Fe3+的氧化性强于碘单质,对应反应的离子方程式是___。有人认为这个实验设计存在缺陷,其理由是___。
(5)浸有氢氧化钠溶液的棉花作用是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com