
【题目】下列离子方程式正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32— =CO2↑+ H2O
B.用氢氧化钠检验氯化铵溶液中铵根离子:NH4+ + OH-![]() NH3 ↑+ H2O
NH3 ↑+ H2O
C.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42—=BaSO4↓
D.氯气与NaOH溶液反应:Cl2 + OH-= Cl- + ClO- + H2O
【答案】B
【解析】
A.碳酸钙与稀盐酸反应生成氯化钙、二氧化碳和水,反应的离子方程式为2H+ + CaCO3 =Ca2++CO2↑+ H2O,故A错误;
B.氢氧化钠溶液与氯化铵溶液共热反应生成氯化钠、氨气和水,反应的离子方程式为NH4+ + OH-![]() NH3 ↑+ H2O,故B正确;
NH3 ↑+ H2O,故B正确;
C.硫酸铜溶液与氢氧化钡溶液反应生成硫酸钡沉淀和氢氧化铜沉淀,反应的离子方程式为Ba2++SO42—+2OH-+Cu2+=BaSO4↓+Cu(OH)2↓,故C错误;
D.氯气与氢氧化钠溶液反应生成氯化钠、次氯酸钠和水,反应的离子方程式为Cl2 + 2OH-= Cl- + ClO- + H2O,故D错误;
故选B。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
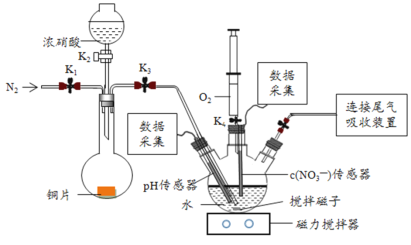
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
步骤II中,传感器记录数据如图所示:
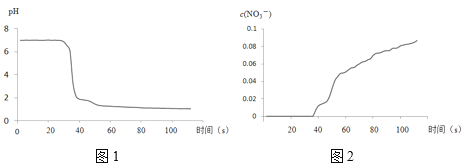
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今年是门捷列夫发现元素周期律151周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是( )

A.常温常压下,Y单质为固态
B.气态氢化物热稳定性:Z<W
C.原子半径:W<X
D.X的最高价氧化物的水化物是强碱
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。分析上述实验中SO2体积分数的结果。甲同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(1)写出产生CO2的化学方程式_____________。
(2)装置A中试剂的作用是______,反应的离子方程式________。
(3)如果气体Y中含有H2,预计实验现象应是____________。
(4)简述确认气体Y中含有CO2的实验现象__________。
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)KMnO4溶液中导管末端做成球状多孔结构的作用是________。
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为___g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】蛇纹石矿可以看作由MgO、Fe2O3、Al2O3、SiO2组成。由蛇纹石制取碱式碳酸镁的实验步骤如下:
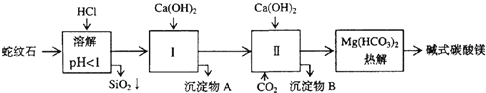
(1)蛇纹石矿加盐酸溶解后,溶液里除了Mg2+外,还含有的金属离子是_____。
(2)从沉淀混合物A含有Fe(OH)3和Al(OH)3)中提取红色氧化物作颜料,先向沉淀物A中加入____溶液 (填入物质的化学式),然后_____、_____、____ (依次填写实验操作名称)。
(3) 物质循环使用,能节约资源。上述实验中,可以循环使用的物质是____(填写物质化学式)。
(4)18.2g产品碱式碳酸镁:aMgCO3·bMg(OH)2·cH2O完全分解后,产生6.6gCO2和8.0g MgO,由此可知,产品的化学式中: a=_____、b=_____、c=___。(列式计算)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是( )

A. 原子半径:W>Z>Y>X
B. 最高价氧化物对应水化物的酸性:X>W>Z
C. 最简单气态氢化物的热稳定性:Y>X>W>Z
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不能用勒夏特列原理解释的是
A. 滴有碘水的淀粉溶液中加入少量唾液,蓝色褪去
B. 对于反应2NO2![]() N2O4加压稳定后的颜色比原来颜色深
N2O4加压稳定后的颜色比原来颜色深
C. 开启可乐瓶,瓶中马上泛起大量气泡
D. 利用排液法收集氯气时常用液体为饱和食盐水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放的对苯二甲酸回收困难,经研究采用ZnO为催化剂,催化脱羧制备苯,脱羧反应机理如下。下列说法中不正确的是
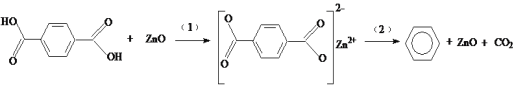
A.过程(1)中断开O—H键需要吸收能量
B.过程(2)中断开C—C键,形成C—H键
C.对苯二甲酸在脱羧反应中被还原为苯
D.ZnO能降低对苯二甲酸脱羧反应的焓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加工含硫原油时,需除去其中含硫物质。
(1)铁离子浓度是原油加工中防腐监测的重要指标。测定铁离子浓度前,需去除原油加工产生的酸性废水中的硫化氢及其盐。实验室模拟过程如下。
Ⅰ.将250mL酸性废水置于反应瓶中,加入少量浓盐酸,调节pH小于5。
Ⅱ.在吸收瓶中加入饱和氢氧化钠溶液。
Ⅲ.打开脱气—吸收装置,通入氮气,调节气流速度,使气体依次经过反应瓶和吸收瓶。当吹出气体中H2S体积分数达到标准,即可停止吹气。
已知:含硫微粒的物质的量分数(δ)随pH变化情况如下图所示。
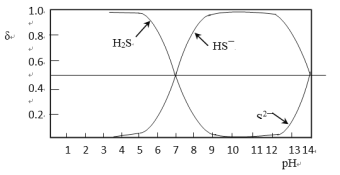
①步骤Ⅰ中加入浓盐酸调节pH<5的原因是_______________________。
②步骤Ⅱ中,当测得吸收液的pH为 ______时,需要更换NaOH溶液。
③利用邻菲罗啉分光光度法可测定样品中的含铁量。测定前需用盐酸羟基胺(NH2OH·HCl)将Fe3+还原为Fe2+。将下述离子方程式补充完整:_______Fe3++______NH2OH·HCl=____Fe2++N2↑+________+_________+__________Cl-
(2)原油中的硫化氢还可采用电化学法处理,并制取氢气,其原理如下图所示。
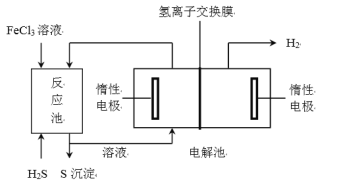
①写出反应池内发生反应的离子方程式_____________________________________。
②电解池中,阳极的电极反应为_____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com