
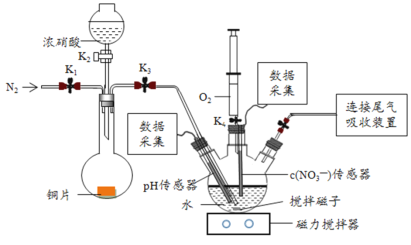
【题目】实验小组为验证NO2与水反应的产物,用如图所示装置进行实验(夹持装置已略去,气密性已检验)。
(实验过程)
实验步骤 | 实验现象 |
Ⅰ.打开K1、K3、K5,关闭K2、K4,通入一段时间N2,关闭K1 | —— |
Ⅱ.打开K2,放入足量浓HNO3,同时打开pH传感器和NO3-传感器,记录数据 | 圆底烧瓶中反应剧烈,铜片逐渐溶解,溶液变为蓝绿色, ;片刻后,三颈瓶内的导管口有气泡冒出 |
III.5min后,打开K4,用注射器将少量空气注入三颈瓶,关闭K4 | 三颈瓶内的气体从无色变为浅红棕色 |
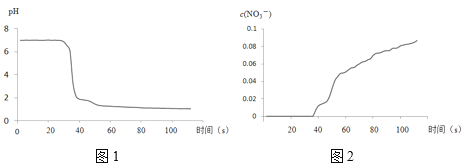
步骤II中,传感器记录数据如图所示:
(解释及结论)
(1)NO2与水反应的离子方程式为___。
(2)步骤I中,通入N2的目的是___。
(3)将步骤II中圆底烧瓶内的实验现象补充完整:___。
(4)该实验验证NO2与水反应产物的实验证据包括___(填序号)。
A.圆底烧瓶中溶液变为蓝绿色
B.三颈瓶内的气体从无色变为浅红棕色
C.pH传感器记录所得数据
D.NO3-传感器记录所得数据
(5)有同学认为该实验不严谨,因为也可能导致传感器所记录的数据结果___。
【答案】3NO2+H2O=2H++2NO3-+NO 排出装置中的氧气(空气) 有红棕色气体生成 BCD 圆底烧瓶中浓硝酸的挥发
【解析】
打开K1、K3、K5,关闭K2、K4,通入一段时间N2,排出装置中的氧气(空气);打开K2,放入足量浓HNO3,打开pH传感器和NO3-传感器,铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水;打开K4,用注射器将少量空气注入三颈瓶,三颈瓶内的气体从无色变为浅红棕色的现象可知,二氧化氮与水反应生成一氧化氮和硝酸,生成的一氧化氮被氧气氧化又生成了二氧化氮。
(1)NO2与水反应生成硝酸和一氧化氮,化学反应方程式为:3NO2+H2O=2HNO3+NO,离子反应方程式为:3NO2+H2O=2H++2NO3-+NO,故答案为:3NO2+H2O=2H++2NO3-+NO;
(2)一氧化氮易被空气中的氧气氧化生成二氧化氮,所以通入N2排出装置中的氧气(空气),故答案为:排出装置中的氧气(空气);
(3)步骤II中圆底烧瓶内铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水,所以溶液变为蓝绿色,有红棕色气体生成,故答案为:有红棕色气体生成;
(4)A. 圆底烧瓶中铜与浓硝酸发生反应生成硝酸铜、二氧化氮和水,溶液变为蓝绿色说明生成硝酸铜,不能验证NO2与水反应产物,A错误;
B. 三颈瓶内气体从无色变为浅红棕色,说明一氧化氮与氧气反应生成了二氧化氮,能验证NO2与水反应生成的产物,B正确;
C. pH传感器是用来检测被测物中氢离子浓度并转换成相应的可用输出信号的传感器,随着反应的进行,pH传感器记录所得数据表示,pH减小,酸性增强,能验证NO2与水反应生成的产物,C正确;
D. 随着反应的进行,NO3-传感器记录所得数据表示,NO3-的浓度增大,能验证NO2与水反应生成的产物,D正确;故答案为:BCD;
(5)浓硝酸易挥发,该实验不严谨,有可能导致传感器所记录的数据结构式圆底烧瓶中挥发出来的浓硝酸,故答案为:圆底烧瓶中浓硝酸的挥发。


科目:高中化学 来源: 题型:
【题目】硒(Se)和铜(Cu)在生产生活中有广泛的应用。硒可以用作光敏材料、电解锰行业的催化剂,也是动物体必需的营养元素和对植物有益的营养元素等。氯化亚铜(CuCl)广泛应用于化工、印染、电镀等行业。CuCl难溶于醇和水,可溶于氯离子浓度较大的体系,在潮湿空气中易水解氧化。以海绵铜(主要成分是Cu和少量CuO)为原料,采用硝酸铵氧化分解技术生产CuCl的工艺过程如下所示:
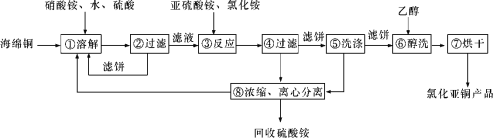
请回答下列问题:
(1)若步骤①中得到的氧化产物只有一种,则它的化学式是____________。
(2)写出步骤③中主要反应的离子方程式:____________________________________。
(3)步骤⑤包括用pH=2的溶液酸洗、水洗两步操作,酸洗采用的酸是__________(写酸的名称)。
(4)上述工艺中,步骤⑥和⑦的作用是_____________。
(5)Se为ⅥA族元素,用乙二胺四乙酸铜阴离子水溶液和硒代硫酸钠(Na2SeSO3)溶液反应可获得纳米硒化铜,硒代硫酸钠还可用于Se的精制,写出硒代硫酸钠(Na2SeSO3)与H2SO4溶液反应得到精硒的化学方程式:_____。
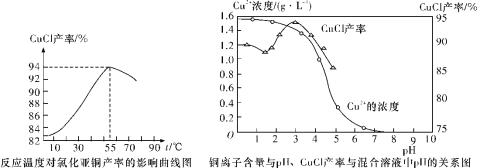
(6)氯化亚铜产率与温度、溶液pH关系如下图所示。据图分析,流程化生产氯化亚铜的过程中,温度过低影响CuCl产率的原因是____________________________________;温度过高、pH过大也会影响CuCl产率的原因是_______________________________。
(7)用NaHS作污水处理的沉淀剂,可以处理工业废水中的Cu2+。已知:25℃时,H2S的电离平衡常数Ka1=1.0×10-7,Ka2=7.0×10-15,CuS的溶度积为Ksp(CuS)=6.3×10-36。反应Cu2+(aq)+HS-(aq) ![]() CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
CuS(s)+H+(aq)的平衡常数K=__________(结果保留1位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】与![]() 互为同分异构体的是( )
互为同分异构体的是( )
A.OHCCH2CH2CHOB.CH3CH2OCH2CH2OH
C.CH3CH=CHCOOHD.HOCH2CH=CHCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、T、Q、W在元素周期表中的相对位置如图所示,其中T所处的周期序数与族序数相等。下列判断不正确的是( )

A. 最简单气态氢化物的热稳定性:R>Q
B. 最高价氧化物对应水化物的酸性:Q<W
C. 原子半径:T>Q>R
D. T的最高价氧化物对应的水化物不能和强碱反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是铜锌原电池示意图。图2中,x轴表示实验时流入正极的电子的物质的量,y轴表示( )

A. c(H+) B. V(H2) C. m(溶液) D. m(Cu)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法正确的是
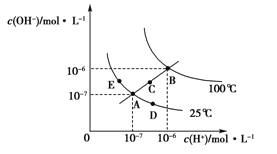
A. 图中五点KW间的关系:B>C>A=D=E
B. 若从A点到D点,可采用在水中加入少量NaOH的方法
C. 若从A点到C点,可采用温度不变时在水中加入适量H2SO4 的方法
D. 若处在B点时,将pH=2的硫酸与pH=12的KOH等体积混合后,溶液显中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和碳的化合物在人类生产、生活中的应用非常广泛。“低碳生活”不再只是一种理想,更是一种值得期待的生活方式。
(1)甲烷燃烧时放出大量的热,可作为能源应用于人类的生产和生活。
已知:①2CH4(g)+3O2(g)=2CO(g)+4H2O(1) △H1=-1214.6kJ/mol;
②2CO(g)+O2(g)=2CO2(g) △H2=-566kJ/mol;
则反应CH4(g)+2O2(g)==CO2(g)+2H2O(1)的△H=___。
(2)将两个石墨电极插入KOH溶液中,向两极分别通入CH4和O2,构成甲烷燃料电池。其负极电极反应式是___。
(3)将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中,进行反应:CO(g)+H2O(g)![]() CO2(g)+H2(g),得到如下三组数据:
CO2(g)+H2(g),得到如下三组数据:
起始量/mol | 平衡量/mol | |||||
实验组 | 温度/℃ | H2O | CO | CO2 | CO | 达到平衡所需时间/min |
1 | 650 | 2 | 4 | 1.6 | 2.4 | 5 |
2 | 900 | 1 | 2 | 0.4 | 1.6 | 3 |
3 | 900 | a | b | c | d | t |
①实验1中,以v(H2)表示的平均反应速率为___;
②该反应的正反应为___ (填“吸”或“放”)热反应;
③若要实验3达到与实验2相同的平衡状态(即各物质的体积分数分别相等),则a、b应满足的关系是___(用含a、b的数学式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.实验室用大理石和稀盐酸制取CO2:2H+ + CO32— =CO2↑+ H2O
B.用氢氧化钠检验氯化铵溶液中铵根离子:NH4+ + OH-![]() NH3 ↑+ H2O
NH3 ↑+ H2O
C.在硫酸铜溶液中加入过量氢氧化钡溶液 Ba2++SO42—=BaSO4↓
D.氯气与NaOH溶液反应:Cl2 + OH-= Cl- + ClO- + H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com