
【题目】已知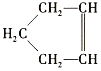 可简写为
可简写为![]() ,降冰片烯的分子结构可表示为
,降冰片烯的分子结构可表示为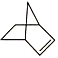 。
。
(1)降冰片烯属于(___________)(填序号)
A.环烃 B.不饱和烃 C.烷烃 D.芳香烃
(2)降冰片烯的分子式为__。
(3)降冰片烯不具有的性质是(___________)(填序号)
A.能溶于水 B.能发生氧化反应
C.能发生加成反应 D.常温常压下为气体
科目:高中化学 来源: 题型:
【题目】两个化学兴趣小组进行了以下探究活动:
第一组:为研究铁质材料与热浓硫酸的反应,称取铁钉(碳素钢)12.0g放入30.0mL浓硫酸中,加热,充分反应后得到溶液X并收集到气体Y。甲同学取672 mL(标准状况)气体Y通入足量溴水中,发生反应:SO2+Br2+2H2O=2HBr+H2SO4,然后加入足量BaCl2溶液,经适当操作后得到干燥固体4.66g。分析上述实验中SO2体积分数的结果。甲同学认为气体Y中还可能含有H2和CO2气体。为此设计了下列探究实验装置(图中夹持仪器省略)。

(1)写出产生CO2的化学方程式_____________。
(2)装置A中试剂的作用是______,反应的离子方程式________。
(3)如果气体Y中含有H2,预计实验现象应是____________。
(4)简述确认气体Y中含有CO2的实验现象__________。
第二组:拟用下列装置定量分析空气中SO2的含量:

(5)KMnO4溶液中导管末端做成球状多孔结构的作用是________。
(6)该实验中已经知道的数据有气体流速a L/min、酸性KMnO4溶液的体积b L,其浓度为c mol/L。若从气体通入到紫色恰好褪去,用时5分钟。则此次取样处的空气中二氧化硫含量为___g/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业排放的对苯二甲酸回收困难,经研究采用ZnO为催化剂,催化脱羧制备苯,脱羧反应机理如下。下列说法中不正确的是
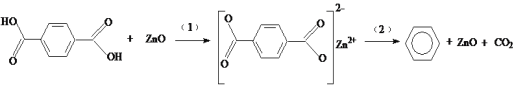
A.过程(1)中断开O—H键需要吸收能量
B.过程(2)中断开C—C键,形成C—H键
C.对苯二甲酸在脱羧反应中被还原为苯
D.ZnO能降低对苯二甲酸脱羧反应的焓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将漫射日光照射到装有氯气和甲烷混合气体(体积比为4∶1)的装置上(如图)。现列出如下现象,其中正确的是( )
①试管内黄绿色逐渐消失 ②试管内黄绿色加深 ③无任何现象 ④试管内液面上升 ⑤试管内壁上有油状物生成

A. ① B. ①④和⑤
C. ①和⑤ D. ②和⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是一种重要的有机化工原料,其结构简式为![]() ,它一般不可能具有的性质是( )
,它一般不可能具有的性质是( )
A.难溶于水,易溶于有机溶剂,在空气中燃烧产生黑烟
B.分子中的所有原子一定在同一平面内
C.它能使溴的四氯化碳溶液褪色,也能使酸性高锰酸钾溶液褪色
D.能发生加成反应,在一定条件下最多可与四倍物质的量的氢气加成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下:
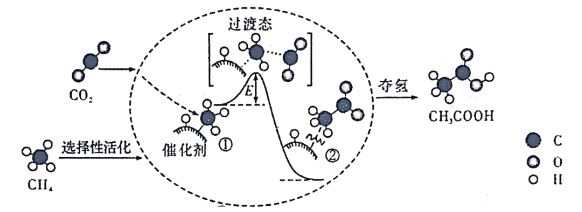 下列说法不正确的是( )
下列说法不正确的是( )
A.生成CH3COOH总反应的原子利用率为100%
B.CH4→CH3COOH过程中,有C—H键发生断裂.
C.①→②过程吸收能量并形成了C—C键
D.该催化剂对该反应的平衡转化率无影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加工含硫原油时,需除去其中含硫物质。
(1)铁离子浓度是原油加工中防腐监测的重要指标。测定铁离子浓度前,需去除原油加工产生的酸性废水中的硫化氢及其盐。实验室模拟过程如下。
Ⅰ.将250mL酸性废水置于反应瓶中,加入少量浓盐酸,调节pH小于5。
Ⅱ.在吸收瓶中加入饱和氢氧化钠溶液。
Ⅲ.打开脱气—吸收装置,通入氮气,调节气流速度,使气体依次经过反应瓶和吸收瓶。当吹出气体中H2S体积分数达到标准,即可停止吹气。
已知:含硫微粒的物质的量分数(δ)随pH变化情况如下图所示。
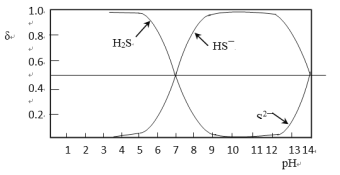
①步骤Ⅰ中加入浓盐酸调节pH<5的原因是_______________________。
②步骤Ⅱ中,当测得吸收液的pH为 ______时,需要更换NaOH溶液。
③利用邻菲罗啉分光光度法可测定样品中的含铁量。测定前需用盐酸羟基胺(NH2OH·HCl)将Fe3+还原为Fe2+。将下述离子方程式补充完整:_______Fe3++______NH2OH·HCl=____Fe2++N2↑+________+_________+__________Cl-
(2)原油中的硫化氢还可采用电化学法处理,并制取氢气,其原理如下图所示。
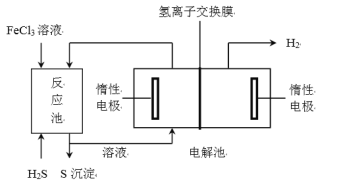
①写出反应池内发生反应的离子方程式_____________________________________。
②电解池中,阳极的电极反应为_____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某天然有机化合物A仅含C、H、O元素,与A相关的反应框图如下:
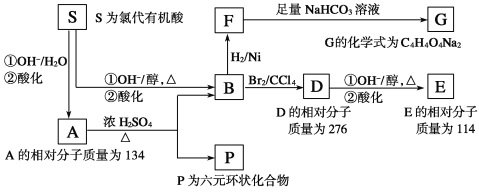
(提示:A→P、A→B分别为两个反应,条件均为浓硫酸、加热)
(1)写出下列反应的反应类型:B→D________;D→E第①步反应________。
(2)请分别写出D和E中的不含氧官能团的名称:D:__________ 、E:____________。
(3)写出S、P的结构简式:
S:_________________________________;P:____________________________;
(4)写出在浓H2SO4存在并加热的条件下,F与足量乙醇反应的化学方程式:____________。
(5)写出符合条件的D的同分异构体的结构简式:(①与D具有相同官能团,②核磁共振氢谱中能呈现2种峰;峰面积比为1∶1)______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com