
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
【答案】C
【解析】
本题主要考查化学反应中物质的浓度变化与化学计量数关系。
A.转化率=![]() ,根据表格信息得出结论即可;
,根据表格信息得出结论即可;
B.由表格中数据求出各物质的浓度变化比例,得出化学方程式;
C.平衡常数只与温度有关;
D.温度升高,吸热方向化学平衡常数增大。
A.达到平衡时,X的转化率为![]() =50%,正确;B.由表可知,X、Y作为反应物,Z作为生成物,
=50%,正确;B.由表可知,X、Y作为反应物,Z作为生成物,![]() 、
、![]() 、
、![]() ,由此可知该反应X、Y、Z的系数比为1:3:2,即反应可表示为X+3Y
,由此可知该反应X、Y、Z的系数比为1:3:2,即反应可表示为X+3Y![]() 2Z,故B正确;C.增大压强,平衡向气体体积减小的方向移动,由B项可知,该反应正向为气体体积减小的反应,故平衡正向移动,而化学平衡常数只与温度有关,改变压强对平衡常数无影响,错误;D.升高温度,平衡向吸热方向移动,若升高温度平衡常数增大,则说明向正向移动,即正向为吸热反应,正确。
2Z,故B正确;C.增大压强,平衡向气体体积减小的方向移动,由B项可知,该反应正向为气体体积减小的反应,故平衡正向移动,而化学平衡常数只与温度有关,改变压强对平衡常数无影响,错误;D.升高温度,平衡向吸热方向移动,若升高温度平衡常数增大,则说明向正向移动,即正向为吸热反应,正确。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】主族元素X、Y、Z、W、R的原子序数依次增大,且它们的原子序数均不超过20。已知X原子最外层电子数是其最内层电子数的2倍,Y的最高正价与最低负价代数和为2,Z的周期数等于其族序数,W的最外层电子数与X的核外电子数相等,R的最外层电子数等于W和X的最外层电子数之差。下列说法正确的是
A.原子半径的大小顺序:r(W)>r(Z)>r(X)
B.最高价氧化物对应水化物的酸性:X>Y
C.常温下Z的单质与Y的最高价含氧酸浓溶液不发生反应
D.最高价氧化物对应水化物的碱性:Z<R
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用铁的氧化物在高温条件下循环裂解水制氢气的流程如下图所示。

(1)反应I的化学方程式为:Fe3O4(s)+CO(g)![]() 3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
3FeO(s)+CO2(g),反应Ⅱ的化学方程式为_________,对比反应I、Ⅱ,铁的氧化物在循环裂解水制氢气过程中的作用是_________。用化学方程式表示反应I、Ⅱ、Ⅲ的总结果:_________。
(2)反应III为:CO2(g)+C(s)![]() 2CO(g)
2CO(g) ![]() H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
H>0。为了提高达平衡后CO的产量,理论上可以采取的合理措施有_________(任写一条措施)。
(3)上述流程中铁的氧化物可用来制备含有Fe3+的刻蚀液,用刻蚀液刻蚀铜板时,可观察到溶液颜色逐渐变蓝,该反应的离子方程式为_________。刻蚀液使用一段时间后会失效,先加酸,再加入过氧化氢溶液,可实现刻蚀液中Fe3+的再生,该反应的离子方程式为_________。
(4)上述流程中碳的氧化物可用来制备碳酰肼[CO(NHNH2)2,其中碳元素为+4价]。加热条件下,碳酰肼能将锅炉内表面锈蚀后的氧化铁转化为结构紧密的四氧化三铁保护层,并生成氮气、水和二氧化碳。该反应的化学方程式为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的密闭容器中,对于可逆反应A(s)+3B(g)![]() 2C(g),下列说法不能说明达到化学平衡状态的是
2C(g),下列说法不能说明达到化学平衡状态的是
A. 气体密度不再变化 B. 混合气体的总压强不再变化;
C. A、B、C的物质的量之比为1∶3∶2 D. 混合气体的平均相对分子质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0.25 mol CH4在标准状况下的体积为_______L,0.25 mol CH4中含有______个氢原子。
(2)相同质量的CO和CO2,它们所含的原子数之比为_______,标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为__________。
(4)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(5)标准状况下有①0.112 L水 ②0.5NA个HCl分子③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne所含原子个数从大到小的顺序为_____。
(6)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为__________g。
(7)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式________________________。
(8)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出V/2mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________。(用含有m、V的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设一个12C原子的质量为a g,一个16O原子的质量为b g,阿伏加德罗常数为NA,则12C16O2的相对分子质量与以下哪些数值相同
①a+2b ②(a+2b)NA ③![]() ④
④![]()
A.①③B.②③C.①④D.②④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.将少量饱和氯化铁溶液滴入沸水中,继续煮沸,可制得Fe(OH)3胶体,反应的方程式为:FeCl3 + 3H2O![]() Fe(OH)3(胶体) + 3HCl。
Fe(OH)3(胶体) + 3HCl。
①当溶液呈__时,停止加热,即制得Fe(OH)3胶体。
②氢氧化铁胶体粒子直径大小的范围是________。
③下列叙述错误的是_____。
A.雾属于胶体,能产生丁达尔效应
B.“PM2.5”悬浮在空气中形成胶体,危害人体健康 (“PM2.5”指大气中直径小于或等于2.5微米的细小颗粒物,也可称为可吸入肺颗粒物)
C.明矾、硫酸铁可以净水,净水原理和胶体有关
D.胶体在一定条件下能稳定存在,属于介稳体系
Ⅱ.(1)下列4组物质均有一种物质的类别与其它3种不同
A.CaO、Na2O、CO2、CuO B. H2、C、P、Cu
C.O2、Fe、Cu、Zn D. HCl、H2O、H2SO4、HNO3
以上四组物质中与其他不同的物质依次是(填化学式):A__;B__;C___;D___。
(2)下列物质:①HCl②蔗糖③NaOH④KCl⑤SO2⑥Fe⑦碳酸钠溶液,属于电解质的是:__(填序号)能导电的是:____(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种制备高效漂白剂NaClO2的实验流程如图所示,反应I中发生的反应为3NaClO3+4SO2+3H2O====2ClO2+Na2SO4+3H2SO4+NaCl,下列说法中正确的是

A. 反应Ⅱ中H2O2做还原剂
B. 产品中含有SO42-、Cl-
C. NaClO2的漂白原理与SO2相同
D. 实验室进行结晶操作通常在坩埚中进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铝(AlP)是一种常用于粮食仓储的广谱性熏蒸杀虫剂,遇水立即产生高毒性气体PH3(沸点-89.7℃,还原性强)。国家卫计委规定粮食中磷化物(以PH3计)的残留量不超过0.05mg/kg时为质量合格,反之不合格。某化学兴趣小组的同学用下述方法测定某粮食样品中残留磷化物的质量以判断是否合格。
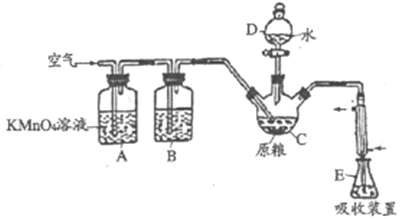
在C中加入100g原粮,E中加入20.00mL2.50×10-4mol/ L KMnO4溶液(H2SO4酸化),往C中加入足量水,充分反应后,用亚硫酸钠标准溶液滴定E中过量的KMnO4溶液。回答下列问题:
(1)PH3的电子式为___________。仪器D的名称是___________。
(2)通入空气的作用是___________。
(3)装置B中盛装焦性没食子酸的碱性溶液,其作用是吸收空气中的O2。若去掉该装置,对实验的影响为___________。
(4)装置E中PH3被氧化成磷酸,则装置E中发生反应的离子方程式为__________。收集装置E中的吸收液,加水稀释至250mL,取25.00mL于锥形瓶中,用4.0×10-5mol/L的Na2SO3标准溶液滴定剩余的KMnO4溶液,消耗Na2SO3标准溶液20.00mL,Na2SO3与KMnO4溶液反应的离子方程式为:SO32-+MnO4-+H+→SO42-+Mn2++H2O(未配平),则该原粮样品中磷化物(以PH3计)的质量为__________mg。该原粮样品__________(填“合格”或“不合格”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com