
【题目】物质的量是高中化学常用的物理量,请完成以下有关计算:
(1)0.25 mol CH4在标准状况下的体积为_______L,0.25 mol CH4中含有______个氢原子。
(2)相同质量的CO和CO2,它们所含的原子数之比为_______,标准状况下,含有相同氧原子数的CO和CO2的体积之比为________。
(3)在9.5 g某二价金属的氯化物中含有0.2 mol Cl-,此氯化物的摩尔质量为________,该金属元素的相对原子质量为__________。
(4)若ag某气体中含有的分子数为b,则cg该气体在标准状况下的体积是___________(设NA为阿伏加德罗常数的值)。
(5)标准状况下有①0.112 L水 ②0.5NA个HCl分子③25.6 g SO2气体 ④0.2 mol氨气(NH3) ⑤2 mol Ne所含原子个数从大到小的顺序为_____。
(6)6.72 L CO(标准状况)与一定量的Fe2O3恰好完全反应(生成Fe与CO2)后,生成Fe的质量为__________g。
(7)某温度时,一定量的元素A的气态氢化物AH3,在恒温密闭容器中分解为两种气体单质,此时压强增加了75%,则AH3分解反应的化学方程式________________________。
(8)V mL Fe2(SO4)3溶液中,含有Fe 3+ m g,取出V/2mL该溶液稀释至4V mL,则溶液中SO42-的物质的量浓度为___________。(用含有m、V的式子表示)
【答案】5.6 6.02 ×1023 或NA 22 : 21 2 : 1 95 g·mol-1 24 ![]() ①>⑤>③>②>④ 11.2 4AH3=A4+6H2 375m/112Vmol·L 1
①>⑤>③>②>④ 11.2 4AH3=A4+6H2 375m/112Vmol·L 1
【解析】
(1)根据![]() 计算甲烷的体积,根据化学式组成计算氢原子的个数;
计算甲烷的体积,根据化学式组成计算氢原子的个数;
(2)根据![]() 计算等质量CO和CO2的物质的量,进而计算原子总数之比;
计算等质量CO和CO2的物质的量,进而计算原子总数之比;
根据化学式组成计算含有相同氧原子数的CO和CO2物质的量之比,再根据相同条件下,气体的体积比等于其物质的量之比,计算二者体积之比;
(3)设该二价金属氯化物的化学式为ACl2,其含有0.2 molCl,可知氯化物ACl2的物质的量为0.1mol,根据![]() 计算摩尔质量,再根据相对分子质量在数值上与摩尔质量相等计算A的相对原子质量;
计算摩尔质量,再根据相对分子质量在数值上与摩尔质量相等计算A的相对原子质量;
(4)对于一定量气体有以下关系:![]() ,先利用ag某气体中含有的分子数为b,计算出气体的摩尔质量,再计算cg该气体的物质的量,最后计算cg该气体在标准状况下的体积;
,先利用ag某气体中含有的分子数为b,计算出气体的摩尔质量,再计算cg该气体的物质的量,最后计算cg该气体在标准状况下的体积;
(5)利用以下公式![]() 、
、![]() ,分别计算原子的物质的量,再进行比较;
,分别计算原子的物质的量,再进行比较;
(6)先计算标况下CO的物质的量,再计算反应中CO失去电子物质的量,根据得失电子守恒计算反应生成铁的物质的量,进而计算Fe的质量;
(7)根据恒温、恒容条件下,气体的压强之比等于其物质的量之比判断反应前后物质的化学计量数的关系,再结合质量守恒定律得出方程式;
(8)根据稀释前后溶质物质的量不变进行计算;
(1)CH4在标准状况下的体积![]() ,0.25 mol CH4含有氢原子的物质的量为0.25mol×4=1mol,则氢原子个数为NA个,约等于6.02 ×1023个;
,0.25 mol CH4含有氢原子的物质的量为0.25mol×4=1mol,则氢原子个数为NA个,约等于6.02 ×1023个;
故答案为:5.6;6.02 ×1023或NA;
(2)设CO和CO2的质量均为mg,二者物质的量之比为![]() ,等物质的量的CO和CO2原子总数之比2:3,则相同质量的CO和CO2气体原子总数之比为22:21;
,等物质的量的CO和CO2原子总数之比2:3,则相同质量的CO和CO2气体原子总数之比为22:21;
含有相同氧原子数的CO和CO2物质的量之比为2:1,相同条件下,气体的体积比等于其物质的量之比,则二者体积之比为2:1;
故答案为:22:21;2:1;
(3)设该二价金属的氯化物的化学式为ACl2,其含有0.2 molCl-,可知氯化物ACl2的物质的量为0.1mol,则此氯化物的摩尔质量为![]() ,所以ACl2的相对分子质量为95,则A的相对原子质量为9535.5×2=24;
,所以ACl2的相对分子质量为95,则A的相对原子质量为9535.5×2=24;
故答案为:95 g·mol-1;24;
(4)a g该气体的物质的量为![]() ,该气体的摩尔质量为
,该气体的摩尔质量为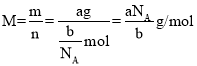 ,则cg该气体的物质的量为
,则cg该气体的物质的量为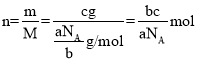 ,
,
cg该气体在标准状况下的体积是![]() ;
;
故答案为:![]() ;
;
(5)标准状况下,①0.112 L水的质量为![]() ,原子总物质的量为
,原子总物质的量为![]() ;
;
②0.5NA个HCl分子物质的量为0.5mol,则原子总物质的量为1mol;
③25.6 g SO2物质的量为![]() ,则原子总物质的量为1.2mol;
,则原子总物质的量为1.2mol;
④0.2 mol氨气(NH3)原子总物质的量为0.8mol;
⑤2 mol Ne,Ne为单原子分子;
综上所述,所含原子个数从大到小的顺序为①>⑤>③>②>④;
故答案为:①>⑤>③>②>④;
(6)标况下6.72L CO的物质的量为![]() ,0.3mol CO 完全反应生成CO2失去电子物质的量为0.3mol×(4-2)=0.6mol,根据得失电子守恒知,反应生成铁的物质的量为0.6mol/3=0.2mol,则生成Fe的质量为
,0.3mol CO 完全反应生成CO2失去电子物质的量为0.3mol×(4-2)=0.6mol,根据得失电子守恒知,反应生成铁的物质的量为0.6mol/3=0.2mol,则生成Fe的质量为![]() ;
;
故答案为:11.2;
(7)恒温、恒容条件下,气体的压强之比等于其物质的量之比,一定量的元素A的氢化物AH3,在恒温密封容器中完全分解为两种气态单质,此时压强增加了75%,则反应前后压强之比=1:(1+75%)=4:7,同一化学反应中混合气体的物质的量之比等于其计量数之和的比,所以反应前后AH3与氢气和A物质的计量数之和之比为4:7,结合质量守恒定律得方程式为4AH3=A4+6H2;
故答案为:4AH3=A4+6H2;
(8)V mL Fe2(SO4)3溶液中,含有的Fe3+的物质的量为![]() ,则SO42物质的量为
,则SO42物质的量为![]() ,V/2mL该溶液中SO42物质的量为
,V/2mL该溶液中SO42物质的量为![]() ,加水稀释至4V mL,溶液中SO42-的物质的量浓度为
,加水稀释至4V mL,溶液中SO42-的物质的量浓度为![]() ;
;
故答案为:375m/112Vmol·L-1。


科目:高中化学 来源: 题型:
【题目】《 Journal of Energy Chemistry》报导我国科学家设计CO2熔盐捕获与转化装置如图。下列有关说法正确的是

A. a为负极
B. 熔盐可用KOH溶液代替
C. d极电极反应式为CO32-+4e-===C+3O2-
D. 转移lmol电子可捕获CO211.2L(标况下)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。完成下列填空:
(1)已知碘元素最终变为无色HIO3。上述整个过程中的还原剂是_______________________。写出CCl4层变成紫色的离子反应方程式________________________________________。
(2)若把KI换成KBr,则CCl4层变为_________色,继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是______________________________________。
(3)智利硝石矿层中含有碘酸钠,可用亚硫酸氢钠与其反应来制备单质碘。试配平该反应的化学方程式,并用短线标出电子转移方向及总数__NaIO3+NaHSO3→NaHSO4+Na2SO4+I2+_H2O,已知含氧酸盐的氧化作用随溶液酸性的加强而增强,在制备试验时,定时取样,并用酸化的氯化钡来检测SO42-离子生成的量,发现开始阶段反应速度呈递增的趋势,试简述这变化趋势发生的原因:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)用CCl4萃取碘水中的碘,下图的分液漏斗中,下层液体呈______色;打开分液漏斗活塞,却未见液体流下,原因可能是_____。

Ⅱ 某同学用某种粗盐进行提纯实验,步骤见下图。

请回答下列问题:
(1)步骤①和②的操作名称是________。
(2)步骤③判断加入盐酸“适量”的方法是______________;步骤④加热蒸发时要用玻璃棒不断搅拌,这是为了____________,当蒸发皿中有较多量固体出现时,应停止加热,用余热使水分蒸干。
(3)猜想和验证:
猜想 | 验证的方法 | 现象 | 结论 |
猜想Ⅰ:固体A中含CaCO3、MgCO3 | 取少量固体A于试管中,滴加稀盐酸,并用涂有澄清石灰水的小烧杯罩于试管口 | _______ | 猜想Ⅰ成立 |
猜想Ⅱ:固体A中含BaCO3 | 取少量固体A于试管中,先滴入________,再滴入Na2SO4溶液 | 有气泡放出,无白色沉淀 | _____ |
猜想Ⅲ:最后制得的NaCl晶体中还含有Na2SO4 | 取少量NaCl晶体溶于试管中的蒸馏水,________ | _______ | 猜想Ⅲ成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要0.1 mol·L-1 NaOH溶液450 mL和0.5 mol·L-1硫酸溶液500 mL。根据这两种溶液的配制情况回答下列问题:

(1)①如图所示的仪器中配制溶液肯定不需要的是____________________(填字母),
②配制上述溶液还需用到的玻璃仪器是__________________(填仪器名称)。
③下列有关容量瓶使用说法不正确的是( )
a.容量瓶使用前一定要检查是否漏液。其操作为装水盖上瓶塞→倒立观察是否漏夜→正立→玻璃塞旋转180°→再倒立观察是否漏夜。
b.不能作为反应容器或长期贮存溶液的容器;但是可以配制任意体积的溶液。
c.不能将固体或浓溶液直接在容量瓶中溶解或稀释;不能加入过冷或过热的液体 。
d.用容量瓶配制溶液,定容时俯视刻度线,所配溶液浓度偏小。
(2)在配制NaOH溶液时:
①根据计算用托盘天平称取NaOH的质量为________g;
②若NaOH溶液在转移至容量瓶时,洒落了少许,则所得溶液浓度___________(填“>”、“<”或“=”)0.1 mol·L-1;
③若NaOH固体溶解后立即移入容量瓶→洗涤烧杯和玻璃棒→洗涤液移入容量瓶→定容,则所得溶液浓度___________(填“>”、“<”或“=”) 0.1 mol·L-1。
(3)在配制硫酸溶液时:
①所需质量分数为98%、密度为1.84 g·cm-3的浓硫酸的体积为__________(计算结果保留一位小数)mL;
②如果实验室有15 mL、50 mL、100 mL量筒,应选用___________mL量筒最好;
③配制过程中需先在烧杯中将浓硫酸进行稀释,稀释时操作方法是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
下列说法错误的是
A. 反应达到平衡时,X的转化率为50%
B. 反应可表示为X+3Y![]() 2Z
2Z
C. 增大压强使平衡向生成Z的方向移动,平衡常数增大
D. 升高温度平衡常数增大,则此反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D 4种可溶性盐,它们的阳离子可能分别是Ca2+、Ag+、Na+、Cu2+中的某一种,阴离子可能分别是NO3-、SO42-、Cl-、CO32-中的某一种。
①若把4种盐分别溶解于盛有蒸馏水的4支试管中,均得澄清溶液,只有B盐的溶液呈蓝色。
②若向①的4支试管中分别加盐酸,C溶液中有沉淀产生,A溶液中有无色无味气体逸出。
(1)根据①②的事实推断B、C的化学式分别为_________、___________
(2)写出A与D反应的化学方程式:______________________________________;
(3)若想从A与D反应后的混合物中分别提取两种固体产物,需要进行的实验操作是_________和________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于臭氧性质的叙述中,不正确的是
A.臭氧比氧气的氧化性更强,常温下能将银、汞等较不活泼的金属氧化
B.臭氧是比氯水更好的消毒剂,因为它在消灭细菌后变成O2,无污染
C.臭氧和活性炭一样,能够吸附有机色素,是种很好的漂白剂
D.臭氧和氧气在一定条件下可以相互转化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有密度为1.25 g·mL-1,质量分数为36.5%的浓盐酸,现需240mL0.1mol·L-1的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为_____。
(2)配制0.1 mol·L-1的盐酸应用量筒量取浓盐酸体积____mL。
(3)配制时,其正确的操作顺序是(用字母表示,每个字母只能用一次,并将所缺内容填在横线上)______。
A.用30 mL蒸馏水洗涤____ 2~3次,洗涤液均注入容量瓶,振荡
B.用量筒准确量取所需的浓盐酸的体积,沿玻璃棒倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C.将已冷却的盐酸沿玻璃棒注入容量瓶中
D.将容量瓶盖紧,振荡,摇匀
E.改用 _____加水,使溶液凹液面恰好与刻度线相切
F.继续往容量瓶内小心加水,直到液面接近刻度线____处
(4)若实验过程中出现如下情况,所配溶液浓度将会怎样?(填偏高或偏低)
①加蒸馏水时不慎超过刻度线_____②量取浓盐酸时仰视______③定容时俯视_______
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com