
【题目】图示表示物质X、Y、Z、W在一定条件下可以按照箭头一步转化。
序号 | X | Y | Z | W |
|
(1) | |||||
(2) |
|
| |||
(3) |
|
|
(1)X是金属单质,焰色反应呈黄色;Y的纯净物易潮解;Z可用于治疗胃酸过多;X在黄绿色的气体中燃烧可以产生白烟W(已知:电解熔融态的W可以得到X)。
X是:___________Y是:___________Z是:__________W是:__________(填写化学式)
(2)Z具有漂白性,但是不稳定,易分解产生含氯化合物。Z是:________(填写化学式)
(3)鉴别X、Y可以滴加___________溶液,前者出现血红色。(填写名称)
【答案】Na NaOH NaHCO3 NaCl HClO 硫氰化钾
【解析】
(1)根据转化关系,X是金属单质,焰色反应呈黄色,则X是Na;Y、Z、W均含有钠元素,根据现象推断Y、Z、W;
(2)由转化关系可知,Z含有氯元素,Z具有漂白性,但是不稳定,易分解产生含氯化合物,则Z是HClO;
(3)鉴别Fe3+、Fe2+可用硫氰化钾溶液。
(1)X是金属单质,焰色反应呈黄色,则X是Na;Y含有钠元素,其纯净物易潮解,则Y是NaOH;Z也含有钠元素,Z可用于治疗胃酸过多,则Z是NaHCO3;Na在Cl2中燃烧生成NaCl ,则W是NaCl。即X是:Na;Y是:NaOH;Z是:NaHCO3;W是:NaCl。
故答案为:Na ;NaOH ;NaHCO3 ;NaCl;
(2)由转化关系可知,Z含有氯元素,Z具有漂白性,但是不稳定,易分解产生含氯化合物,则Z是HClO。
故答案为:HClO;
(3)鉴别Fe3+、Fe2+可以滴加硫氰化钾溶液,出现血红色的是Fe3+,不出现血红色的是Fe2+。
故答案为:硫氰化钾。


 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案科目:高中化学 来源: 题型:
【题目】一定温度下,l mol X和n mol Y在体积为2L的密闭容器中发生如下反应:X(g) + Y(g)![]() 2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
2Z(g) + M(s),5min后达到平衡,此时生成2a mol Z。下列说法正确的是
A. 用X表示5min内此反应的反应速率是(0.1—0.2a)mol·(L·min)—1
B. 当混合气体的质量不再发生变化时,说明反应达到平衡状态
C. 向平衡后的体系中加入l mol M,平衡向逆反应方向移动
D. 向上述平衡体系中再充入l mol X,v(正)增大,v(逆)减小,平衡正向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】沼气是一种能源,它的主要成分是CH4,标准状况下,0.5 mol CH4完全燃烧生成CO2和H2O时,放出445 kJ的热量,则表示CH4燃烧热的热化学方程式正确的是( )
A. ![]() CH4(g)+O2(g)
CH4(g)+O2(g) ![]() CO2(g)+H2O(l) ΔH =445 kJ/mol
CO2(g)+H2O(l) ΔH =445 kJ/mol
B. CH4+2O2CO2+2H2O ΔH=890 kJ/mol
C. CH4(g)+2O2(g)CO2(g)+2 H2O(g) ΔH =890 kJ/mol
D. CH4(g)+2O2(g)CO2(g)+2H2O(l) ΔH = -890 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上监测SO2含量是否达到排放标准的化学反应原理是SO2+H2O2+BaCl2=BaSO4↓+2HCl,用NA表示阿伏伽德罗常数的值,下列说法正确的是( )
A. 标准状况下,0.2 mol/L 的BaCl2溶液中含有的Cl-数目为0.4NA
B. 生成2.33 g BaSO4沉淀时,吸收SO2的体积约为 0.224 L
C. 常温常压下,17 g H2O2中所含分子总数为 0.5NA
D. 标准状况下,每转移1 mol电子,消耗1 mol H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷精矿湿法制备磷酸的一种工艺流程如下:

已知:磷精矿主要成分为Ca5(PO4)3(OH),还含有Ca5(PO4)3F和有机碳等。
溶解度:Ca5(PO4)3(OH)<CaSO4·0.5H2O
(1)上述流程中能加快反应速率的措施有__________。
(2)磷精矿粉酸浸时发生反应:
2Ca5(PO4)3(OH)+3H2O+10H2SO4![]() 10CaSO4·0.5H2O+6H3PO4
10CaSO4·0.5H2O+6H3PO4
①该反应体现出酸性关系:H3PO4__________H2SO4(填“>”或“<”)。
②结合元素周期律解释①中结论:P和S电子层数相同,__________。
(3)酸浸时,磷精矿中Ca5(PO4)3F所含氟转化为HF,并进一步转化为SiF4除去。写出生成HF的化学方程式:__________。
(4)H2O2将粗磷酸中的有机碳氧化为CO2脱除,同时自身也会发生分解。相同投料比、相同反应时间,不同温度下的有机碳脱除率如图所示。80℃后脱除率变化的原因:____________________。

(5)脱硫时,CaCO3稍过量,充分反应后仍有SO42残留,原因是__________;加入BaCO3可进一步提高硫的脱除率,其离子方程式是____________________。
(6)取a g所得精制磷酸,加适量水稀释,以百里香酚酞作指示剂,用b mol·L1NaOH溶液滴定至终点时生成Na2HPO4,消耗NaOH溶液c mL,精制磷酸中H3PO4的质量分数是________。(已知:H3PO4摩尔质量为98 g·mol1)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中加入0.lmolSi及0.3molHCl,加热发生反应:![]() 测得SiHCl3的平衡产率与温度及压强的关系如下图所示:
测得SiHCl3的平衡产率与温度及压强的关系如下图所示:
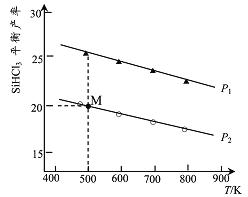
下列说法正确的是
A. 图中P1<P2
B. M点HC1的转化率为10%
C. 平衡时,容器中再加入少量单质Si,HCl的转化率增大
D. 向恒压容器中加入0.2molSi、0.6molHCl,500K、压强为P1时,SiHCl3的平衡产率等于20%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)烷烃A在同温、同压下蒸气的密度是H:的43倍,其分子式为____分子中含102个氢原子的烷烃的分子式是_____
(2)用式量为43的烷基取代甲苯苯环上的一个氢原子,所得芳香烃产物的数目为__种。
(3)有机物 的正确命名为___________
的正确命名为___________
(4)立方烷 它的六氯代物有____种。
它的六氯代物有____种。
(5)  分子中最多有个____原子共面.
分子中最多有个____原子共面.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列做法不符合绿色化学理念的是( )
A. 研制水溶剂涂料替代有机溶剂涂料
B. 用可降解塑料生产包装盒或快餐盒
C. 用反应:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O制备硫酸铜
CuSO4+SO2↑+2H2O制备硫酸铜
D. 用反应:2CH2=CH2+O2![]()
![]() 制备环氧乙烷
制备环氧乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.3molNH3分子中所含原子数与___________个H2O分子中所含原子数相等。
(2)罐头厂在装食物罐头时,通常要添加一些对人体无害的防腐剂,防止食物被空气中的氧气氧化而变质。此类食物防腐剂应具有______________(填“氧化性”或“还原性”);
(3)现有一含有FeCl2 和FeCl3的混合样品,实验测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3 的物质的量分数为_________。
(4)某无色透明溶液中可能大量存在Ag+,Mg2+,Cu2+中的几种离子:
a. 取少量原溶液加入过量稀盐酸,有白色沉淀生成,再加入过量稀硝酸,白色沉淀不消失,
取滤液加入过量NaOH溶液,出现白色沉淀,说明原溶液中肯定存在的离子是_________,
b. 原溶液中可能大量存在的阴离子是下列A-D中的(填序号)_________。
A.Cl- B.NO3- C.CO32- D.OH-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com