
【题目】氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl用作制备碳酸二甲酯的催化剂:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1
①反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是___________________。
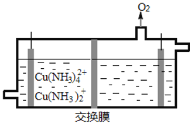
(3)在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为___________________________ 。
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。
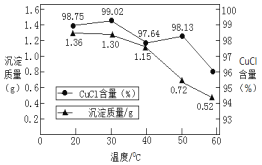
从氯化亚铜产率角度分析,最佳稀释温度为__________________;温度越高得到氯化亚铜沉淀质量越小,其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.___________________。
【答案】2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl –a + b + 2c 溶解 CuCl,防止其覆盖在铜表面阻碍反应进行 ![]() +e–=
+e–=![]() +2NH3 20℃ 温度高CuCl 溶解度增大
+2NH3 20℃ 温度高CuCl 溶解度增大
【解析】
利用总反应减去反应i,便可得到反应ii的化学方程式;借助三个已知热化学方程式,利用盖斯定律,便可求出待求反应的△H;从反应看,Cu、CuCl、CuCl2都呈固态,产物会覆盖在反应物表面,阻止反应的进行,所以加入盐酸便是为了让反应能持续进行;电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀,说明通过电解,将![]() 转化为
转化为![]() ;在稀释前,沉淀质量为一定值,改变温度、加水稀释,由于溶解度的改变,导致固体质量的改变,所以只要利用图中数据,求出CuCl的质量,便可确定CuCl产率最高的点对应的温度;温度越高得到氯化亚铜沉淀质量越小,原因一个为溶解,一个为变质。
;在稀释前,沉淀质量为一定值,改变温度、加水稀释,由于溶解度的改变,导致固体质量的改变,所以只要利用图中数据,求出CuCl的质量,便可确定CuCl产率最高的点对应的温度;温度越高得到氯化亚铜沉淀质量越小,原因一个为溶解,一个为变质。
(1)将总反应“4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O”减去反应“4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O”,便可得到反应ii为2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl。答案为:2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl;
2(CH3O)2CO+2H2O”减去反应“4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O”,便可得到反应ii为2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl。答案为:2Cu(CH3O)Cl + CO = (CH3O)CO + 2CuCl;
(2)Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1 ①
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1 ②
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1 ③
①利用盖斯定律,将反应①+②-③×2得,反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=–a + b + 2c kJ·mol-1。答案为:–a + b + 2c;
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1,由于反应生成的CuCl覆盖在Cu表面,阻止反应的不断进行,所以在实验过程中要加入浓盐酸反应才能持续进行,加入浓盐酸的目的是:溶解 CuCl,防止其覆盖在铜表面阻碍反应进行。答案为:溶解 CuCl,防止其覆盖在铜表面阻碍反应进行;
(3)①电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀,则表明![]() 转化为
转化为![]() ,阴极区电极方程式为
,阴极区电极方程式为![]() +e–=
+e–=![]() +2NH3。 答案为:
+2NH3。 答案为:![]() +e–=
+e–=![]() +2NH3;
+2NH3;
②反应所得固体的质量相同,所含CuCl的质量相同,但由于稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量不同。在20℃时,CuCl2的质量为1.36g×98.75%=1.343g,30℃时,CuCl2的质量为1.30g×99.02%=1.287g,CuCl2的质量越大,产率越高,所以从氯化亚铜产率角度分析,最佳稀释温度为20℃;温度越高得到氯化亚铜沉淀质量越小,可从溶解度和被氧化两个方面分析,所以其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.温度高CuCl 溶解度增大。答案为:20℃;温度高CuCl 溶解度增大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】把0.6mol X气体和0.6mol Y气体混合于2L密闭容器中,使它们发生如下反应:2X(g)+Y(g)=nM(g)+2W(g)2min 末,若测知以W 的浓度变化表示的反应速率为0.05molL﹣1min﹣1,容器内气体的总物质的量与反应前容器内气体的总物质的量之比为5:4,则:
(1)前2min内用Y的浓度变化表示的平均反应速率为___________。
(2)2min末时X的浓度为_________。
(3)化学反应方程式中n的值是____________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阳离子交换膜法电解饱和食盐水具有综合能耗低、环境污染小等优点。生产流程如下图所示:

(1)电解饱和食盐水的化学方程式为________。
(2)电解结束后,能够脱去阳极液中游离氯的试剂或方法是________(填字母序号)。
a.Na2SO4b.Na2SO3
c.热空气吹出d.降低阳极区液面上方的气压
(3)食盐水中的I—若进入电解槽,可被电解产生的Cl2氧化为ICl,并进一步转化为IO3—。IO3—可继续被氧化为高碘酸根(IO4—),与Na+结合生成溶解度较小的NaIO4沉积于阳离子交换膜上,影响膜的寿命。
①从原子结构的角度解释ICl中碘元素的化合价为+1价的原因:________。
②NaIO3被氧化为NaIO4的化学方程式为________。
(4)在酸性条件下加入NaClO溶液,可将食盐水中的I-转化为I2,再进一步除去。通过测定体系的吸光度,可以检测不同pH下I2的生成量随时间的变化,如下图所示。已知:吸光度越高表明该体系中c(I2)越大。

①结合化学用语解释10 min时不同pH体系吸光度不同的原因:________。
②pH=4.0时,体系的吸光度很快达到最大值,之后快速下降。吸光度快速下降的可能原因:________。
③研究表明食盐水中I-含量≤0.2 mgL-1时对离子交换膜影响可忽略。现将1m3含I-浓度为1.47 mgL-1 的食盐水进行处理,为达到使用标准,理论上至少需要0.05 molL-1 NaClO溶液________L。(已知NaClO的反应产物为NaCl,溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列反应的叙述正确的是( )
A.由SiO2+2C![]() Si+2CO↑可推知硅的非金属性比碳强
Si+2CO↑可推知硅的非金属性比碳强
B.由CaCO3+SiO2![]() CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.由Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.由Na2CO3+SiO2![]() Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NA为阿伏加德罗常数的数值,下列说法正确的是
A. 56g铁在足量氧气中燃烧,转移的电子数为2NA
B. lg氢气含有NA个氢气分子
C. 标准状况下,22.4L水含有1mol水分子
D. 2mol钠与过量稀盐酸反应生成NA个氢气分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质.下列实验现象和结论一致且正确的是
A. 加入有色布条,一会儿有色布条褪色,说明溶液中有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 加入AgNO3溶液产生白色沉淀,说明有Cl-分子存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项 | 实验操作和现象 | 结论 |
A | 向蛋白质溶液中加入醋酸铅溶液,产生白色沉淀 | 蛋白质发生了盐析 |
B | SO2通入Ba(NO3)2溶液中,产生白色沉淀 | 沉淀为BaSO3 |
C | 向蔗糖中加入适量浓硫酸并搅拌,蔗糖变黑,体积膨胀,并放出刺激性气味的气体 | 浓硫酸具有脱水性和强氧化性 |
D | 分别向等物质的量浓度的苯酚钠溶液和碳酸钠溶液中滴加酚酞,后者红色更深 | 碳酸酸性强于苯酚 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着电子科技水平的进步,液晶电视、电脑、仪表等电子产品已进入我们的日常生活。下面是工业上用丙烯(A)和有机物 C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:
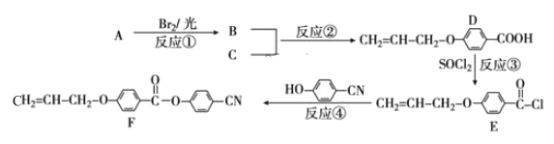
(1)化合物C的名称为_____;反应④的反应类型是 _____。
(2)D 中含氧官能团的名称为____;B的结构简式为 ______。
(3)写出C与足量 NaOH 水溶液反应的离子方程式______。
(4)写出所有符合下列条件下的化合物C的同分异构体的结构简式 ____。
①苯环上一溴代物只有 2 种 ②能发生银镜反应 ③苯环上有3个取代基
(5)化合物D是用于合成一种质子交换膜材料的重要原料。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
已知:R1OH + R2Cl → R1—O—R2+ HCl,
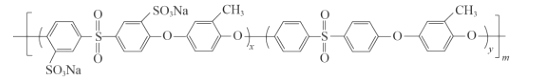
其单体的结构简式是: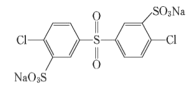 、________、________。
、________、________。
(6)请参照上述制备流程,写出以有机物C、乙烯、![]() 为原料制备
为原料制备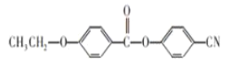 的合成路线流程图(无机试剂任用)__
的合成路线流程图(无机试剂任用)__
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com