
【题目】关于下列反应的叙述正确的是( )
A.由SiO2+2C![]() Si+2CO↑可推知硅的非金属性比碳强
Si+2CO↑可推知硅的非金属性比碳强
B.由CaCO3+SiO2![]() CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.由Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.由Na2CO3+SiO2![]() Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
科目:高中化学 来源: 题型:
【题目】已知:X(g)+3Y(g)![]() 2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
2Z(g),一定条件下,0.3 mol X(g)与0.3 mol Y(g)在体积为1 L的密闭容器中发生反应。下列图示合理的是
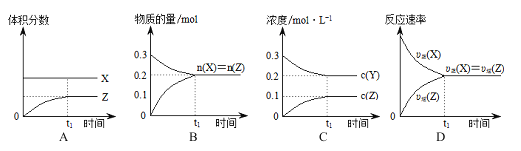
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如下所示。下列说法错误的是
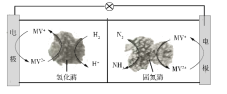
A. 相比现有工业合成氨,该方法条件温和,同时还可提供电能
B. 阴极区,在氢化酶作用下发生反应H2+2MV2+![]() 2H++2MV+
2H++2MV+
C. 正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D. 电池工作时质子通过交换膜由负极区向正极区移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】镁作为目前密度最小的金属材料之一,广泛应用于航空航天工业、军工领域、交通领域。以下为镁的两种冶炼方法。
Ⅰ.目前宁夏已经探明的镁矿储量居全国第一,青龙山白云岩(CaCO3·MgCO3)是皮江法冶炼镁的优质原料,该方法将白云石煅烧为氧化物(CaO·MgO),然后在还原炉中经1 200 ℃高温真空条件下用硅还原MgO生成粗镁,粗镁再经过精炼、铸锭得到成品镁,工艺流程如图所示。
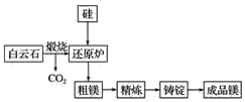
(1)写出还原炉内用硅还原MgO生成粗镁的化学反应方程式:_______________。
Ⅱ.海水综合利用可以制备金属镁,其流程如下图所示:
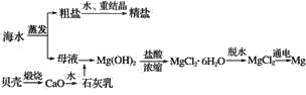
(2)海水中的镁以Mg2+的形式存在,流程中将Mg2+转化为Mg(OH)2,然后又重新转化为Mg2+的目的是___________________________。
(3)综合比较两种方法,皮江法的缺点是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧熔融碳酸盐燃料电池是一种高温电池(600~700℃),具有效率高、噪音低、无污染、燃料多样、余热利用价值高等优点。氢氧熔融碳酸盐燃料电池的工作原理如图所示。下列有关该电池的说法正确的是
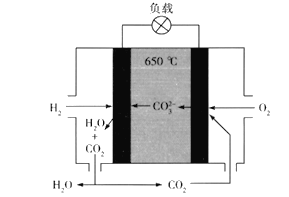
A. 电池工作时,熔融碳酸盐只起到导电的作用
B. 负极反应式为H2 -2e- +CO32-==CO2+H2O
C. 该电池可利用工厂中排出的CO2,减少温室气体的排放
D. 电池工作时,外电路中流过0.2 mol电子,消耗3.2 g O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一密闭容器中,反应aA(g)![]() bB(g)达平衡后,保持温度不变,将容器体积压缩为原来的一半,当达到新的平衡时(A、B还是气体),B的浓度是原来的2.1倍,则
bB(g)达平衡后,保持温度不变,将容器体积压缩为原来的一半,当达到新的平衡时(A、B还是气体),B的浓度是原来的2.1倍,则
A.平衡向正反应方向移动了B.物质A的转化率减少了
C.物质B的质量分数减少了D.a<b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜是有机合成工业中应用较广的催化剂。
(1)CuCl用作制备碳酸二甲酯的催化剂:4CH3OH+2CO+O2![]() 2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
2(CH3O)2CO+2H2O,请填写化学方程式将催化原理补充完整:i.4CuCl+4CH3OH+O2=4Cu(CH3O)Cl+2H2O;ii.________________________。
(2)一种用废铜制备氯化亚铜的过程如下:
Cu(s)+Cl2(g)=CuCl2(s) △H=-a kJ·mol-1
CuCl2(s) +Cu(s) +4HCl(aq)=2H2[CuCl3] (aq) △H=+b kJ·mol-1
CuCl(s) + 2HCl(aq)H2[CuCl3] (aq) △H=-c kJ·mol-1
①反应 2Cu(s)+Cl2(g)=2CuCl(s) △H=_______________ kJ·mol-1(用含 a、b、c 的式子表示)
②向CuCl2 溶液中加入过量铜粉,发生反应生成CuC1。但在实验过程中要加入浓盐酸反应才能持续进行,反应结束后将溶液倒入蒸馏水中稀释获得CuCl。加入浓盐酸的目的是___________________。
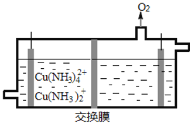
(3)在电解槽中电解氨性含铜蚀刻废液,电解后向阴极液中加入盐酸酸化,再倒入蒸馏水稀释,得到氯化亚铜沉淀。
①电解装置如图所示,阴极区电极方程式为___________________________ 。
②稀释过程中溶液的温度不同,得到沉淀质量和氯化亚铜百分含量变化如图所示。
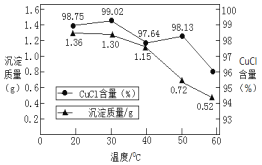
从氯化亚铜产率角度分析,最佳稀释温度为__________________;温度越高得到氯化亚铜沉淀质量越小,其原因可能是:i.加热过程中部分氯化亚铜被氧化;ii.___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下用普通铁粉和水蒸气反应,可以得到铁的氧化物,该氧化物又可以经过此反应的逆反应,生成颗粒很细的铁粉,这种铁粉具有很高的反应活性,在空气中受撞击或受热时会燃烧,所以俗称“引火铁”。请分别用下图中示意的两套仪器装置,制取上述铁的氧化物和“引火铁”。实验中必须使用普通铁粉和6 mol·L-1盐酸,其他试剂自选(装置中必要的铁架台、铁夹、铁圈、石棉网、加热设备等在图中均已略去)。填写下列空白:
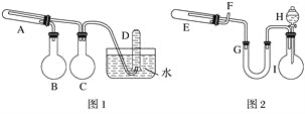
(1)实验进行时试管A中应加入的试剂是__________;烧瓶B的作用是____________;烧瓶C的作用是__________;在试管D中收集得到的是__________。
(2)实验时,U形管G中应加入的试剂是____________;长颈漏斗H中应加入____________。
(3)两套装置中,在实验时需要加热的仪器是(填该仪器对应的字母)__________________。
(4)试管E中发生反应的化学方程式是__________________________。
(5)为了安全,在E管中的反应发生前,在F出口处必须____________;E管中的反应开始后,在F出口处应________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,在 20 mL 0.1 molL-1 一元弱酸HA溶液中滴加0. 1mol L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与 pH 关系如图所示。下列说法正确的是
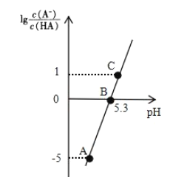
A.A点对应溶液中:c(OH-)>c(H+)
B.25℃时,HA电离常数的数量级为10-5
C.B点对应的 NaOH 溶液体积小于 10 mL
D.对C点溶液加热(不考虑挥发),则![]() 增大
增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com