
【题目】25℃时,在 20 mL 0.1 molL-1 一元弱酸HA溶液中滴加0. 1mol L-1 NaOH溶液,溶液中1g[c(A-)/c(HA)]与 pH 关系如图所示。下列说法正确的是
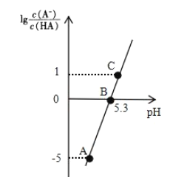
A.A点对应溶液中:c(OH-)>c(H+)
B.25℃时,HA电离常数的数量级为10-5
C.B点对应的 NaOH 溶液体积小于 10 mL
D.对C点溶液加热(不考虑挥发),则![]() 增大
增大
【答案】C
【解析】
A.据图可知A点对应溶液pH<7,所以此时溶液显酸性,c(OH-)<c(H+),故A错误;
B.B点lg![]() =0,即
=0,即![]() =1,此时pH=5.3,即c(H+)=10-5.3mol/L,此时HA电离常数Ka=
=1,此时pH=5.3,即c(H+)=10-5.3mol/L,此时HA电离常数Ka=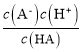 =c(H+)=10-5.3=5.01×10-6,数量级为10-6,故B错误;
=c(H+)=10-5.3=5.01×10-6,数量级为10-6,故B错误;
C.当NaOH的体积为10mL时,溶液中的溶质为等物质的量的HA和NaA,HA电离常数Ka=10-5.3,则Aˉ的水解平衡常数为![]() =10-8.7<10-5.3,所以HA的电离程度比NaA的水解程度要大,即溶液中c(HA)<c(Aˉ),则此时
=10-8.7<10-5.3,所以HA的电离程度比NaA的水解程度要大,即溶液中c(HA)<c(Aˉ),则此时![]() >1,所以若要
>1,所以若要![]() =1,则需要少加入一些NaOH,所以B点对应的NaOH溶液体积小于10 mL,故C正确;
=1,则需要少加入一些NaOH,所以B点对应的NaOH溶液体积小于10 mL,故C正确;
D.![]() 为Aˉ的水解平衡常数的倒数,水解为吸热反应,升高温度,水解平衡常数增大,则其倒数减小,即
为Aˉ的水解平衡常数的倒数,水解为吸热反应,升高温度,水解平衡常数增大,则其倒数减小,即![]() 减小,故D错误;
减小,故D错误;
故答案为C。


科目:高中化学 来源: 题型:
【题目】关于下列反应的叙述正确的是( )
A.由SiO2+2C![]() Si+2CO↑可推知硅的非金属性比碳强
Si+2CO↑可推知硅的非金属性比碳强
B.由CaCO3+SiO2![]() CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
CaSiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
C.由Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓可推知碳的非金属性比硅强
D.由Na2CO3+SiO2![]() Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
Na2SiO3+CO2↑可推知H2SiO3的酸性比H2CO3强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
铁氮化合物(FexNy)在磁记录材料领域有着广泛的应用前景。某FexNy的制备需铁、氮气、丙酮和乙醇参与。
(1)Fe3+基态核外电子排布式为____________________。
(2)丙酮(![]() )分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
)分子中碳原子轨道的杂化类型是_______________,1 mol 丙酮分子中含有σ键的数目为______________。
(3)C、H、O 三种元素的电负性由小到大的顺序为________________。
(4)乙醇的沸点高于丙酮,这是因为____________________。
(5)某FexNy的晶胞如题21图-1所示,Cu可以完全替代该晶体中a位置Fe或者b位置Fe,形成Cu替代型产物Fe(x-n) CunNy。FexNy转化为两种Cu替代型产物的能量变化如题21图-2 所示,其中更稳定的Cu替代型产物的化学式为___________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】品味生活,感知化学
(1)“美食名粽,品位海南”,2017年5月20日海南名粽展销会拉开帷幕。海南粽子的主要食材有:糯米、猪肉、咸蛋黄等。
①以上食材中富含淀粉的是________________;
②从平衡膳食的角度看,吃海南粽子时,还应补充适量的_____________(填营养素名称);
③海南粽子经过真空包装,并添加一定的抗氧化剂后销往各地,抗氧化剂所起的作用是________________
(填“着色”或“防腐”或“调味”);
④粽叶一般选择新鲜的植物叶子,剥下的粽叶为实现无害化、资源化处理,写出一种合理的处理方法_________________________。
(2)下图是一辆大气环境监测汽车,请回答下列问题:

①汽车轮胎所用的主要材料是_________________。
②汽车外壳会喷上各种颜色的油漆,一方面能起到美化作用,另一方面油漆还能为钢铁材料起到________________作用;
③汽车的内饰材料若不合格,易产生一些挥发性有毒物质如________(填“甲醛”或“甲烷”或“乙醇”)而对车内空气造成污染;
④目前,大气环境监测公布的主要污染物有硫的氧化物、氮的氧化物和________(填字母)。
a.二氧化碳 b.氮气 c.可吸入颗粒物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生产、生活等密切相关,从化学视角回答下列问题:
(1)电闪雷鸣的雨天,空气中发生的化学反应会增加雨水的含氮量,有关反应的化学方程式是_____、_______、_________________。
(2)我国以煤炭为主的能源结构决定了我国的酸雨以硫酸型为主,为减少SO2的污染和酸雨的形成,目前常应用石灰法脱硫。过程如下:通过煅烧石灰石得到生石灰,以生石灰为脱硫剂,在吸收塔中与废气中的SO2反应而将硫固定,最终生成CaSO4,有关反应的化学方程式为_______、______、_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度不变、恒容的容器中进行反应2HI![]() H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
H2+I2(正反应为吸热反应),反应物的浓度由0.1 mol/L降到0.06 mol/L,需要20 s,那么由0.06 mol/L降到0.036 mol/L所需时间为( )
A.等于10 sB.等于12 sC.大于12 sD.小于12 s
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着电子科技水平的进步,液晶电视、电脑、仪表等电子产品已进入我们的日常生活。下面是工业上用丙烯(A)和有机物 C(C7H6O3)为原料合成液晶显示器材料(F)的主要流程:
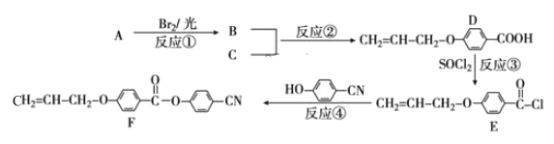
(1)化合物C的名称为_____;反应④的反应类型是 _____。
(2)D 中含氧官能团的名称为____;B的结构简式为 ______。
(3)写出C与足量 NaOH 水溶液反应的离子方程式______。
(4)写出所有符合下列条件下的化合物C的同分异构体的结构简式 ____。
①苯环上一溴代物只有 2 种 ②能发生银镜反应 ③苯环上有3个取代基
(5)化合物D是用于合成一种质子交换膜材料的重要原料。我国科研人员研发的一种质子交换膜材料的结构片段如下,它由三种单体缩聚而成。
已知:R1OH + R2Cl → R1—O—R2+ HCl,
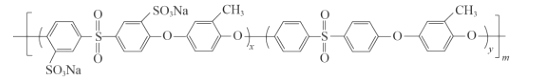
其单体的结构简式是: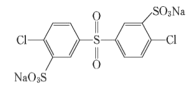 、________、________。
、________、________。
(6)请参照上述制备流程,写出以有机物C、乙烯、![]() 为原料制备
为原料制备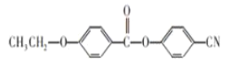 的合成路线流程图(无机试剂任用)__
的合成路线流程图(无机试剂任用)__
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式,并分别用双线桥法和单线桥法表示电子转移的方向和数目。
(1)用氢气还原氧化铜。__、__。
(2)加热氯酸钾分解制取氧气。__、__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1 L含有0.4 mol Cu(NO3)2和0.4 mol KCl的水溶液,用惰性电极电解一段时间后,在一电极上析出19.2 g Cu。此时,在另一电极上放出气体的体积在标准状况下为(不考虑产生的气体在水中的溶解)( )
A.6.72 LB.13.44 LC.3.36 LD.5.6 L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com