
【题目】用“>”或“<”回答下列问题:
(1)酸性:H2CO3H2SiO3
(2)碱性:Mg(OH)2Al(OH)3
(3)气态氢化物稳定性:H2OH2S.
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】常温下,Ksp(CaSO4)=9×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。下列判断错误的是
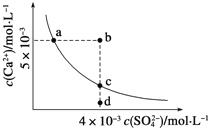
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp等于c点对应的Ksp
C.b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3molL-1
D.向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g) ![]() CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _ mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 。
(3)t2℃时,化学反应CO (g) + H2O (g) ![]() CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ(1)pH相等的NaOH溶液与CH3COONa溶液,分别加热到相同的温度后CH3COONa溶液的pH__________NaOH溶液的pH(填“>”“=”或“<”);
(2)将物质的量浓度相同的盐酸与氨水混合后,溶液中的c(NH4+)=c(Cl-),则盐酸的体积 氨水的体积(填“>”“=”或“<”);
Ⅱ.某烧碱样品中含有少量不与酸作用的可溶性杂质,为了测定烧碱的纯度,进行以下滴定操作:
A.在250mL容量瓶中定容成250![]() 烧碱溶液
烧碱溶液
B.用移液管移取25mL烧碱溶液于锥形瓶中并滴加几滴酚酞指示剂
C.在天平上准确称取烧碱样品W g,在烧杯中加蒸馏水溶解
D.将物质的量浓度为M mol·L-1的标准HCl溶液装入酸式滴定管,调整液面,记下开始刻度数为![]()
E.在锥形瓶下垫一张白纸,滴定到终点,记录终点酸的体积![]()
回答下列问题:
(1)正确的操作步骤的顺序是(用字母填写) → → → D →
(2)若酸式滴定管未用盐酸标准溶液润洗,会对测定结果有何影响 (填“偏高”、“偏低”或“无影响”)。
(3)该烧碱样品的纯度计算式是
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢氧化钠标准溶液因保存不当,吸收了少量的二氧化碳,若有1%的NaOH转变为Na2CO3,以此NaOH溶液滴定未知浓度的盐酸,选用甲基橙作指示剂;盐酸浓度的测定结果会( )
A.偏低1% B.偏高1% C.无影响 D.偏高0.1%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子最外层上只有两个电子,该元素( )
A.一定是金属元素
B.一定能和氢氧化钠溶液反应生成氢气
C.一定是ⅡA族元素
D.可能是金属元素,也可能不是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下图装置中,烧瓶中充满干燥气体a,将滴管中的液体b挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f,烧杯中的液体b呈喷泉状喷出,最终几乎充满烧瓶。则a和b分别是
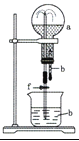
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com