
����Ŀ��һ���¶��£���һ�̶�����������У�ͨ��һ������CO��H2O���������·�Ӧ��CO ��g�� ʮH2O ��g�� ![]() CO2 ��g�� ʮ H2 ��g�� �� ��H��0
CO2 ��g�� ʮ H2 ��g�� �� ��H��0
��1����850��ʱ��CO��H2OŨ�ȱ仯������ͼ���� 0��4min��ƽ����Ӧ����v��CO2���� _ mol��L-1��min-1

��2��t1��ʱ������ͬ�����з���������Ӧ�������ʵ�Ũ�ȱ仯�����ϱ���
�� ����t1���÷�Ӧ��ƽ�ⳣ��ΪK = ��
�� t1��ʱ����Ӧ��5min��6min�䣬ƽ�� �ƶ������������һ� �������ڵ�5���Ӹı�һ�������ﵽ��6���ӵ�Ũ�ȣ��ı�������� ��
��3��t2��ʱ����ѧ��ӦCO ��g�� + H2O ��g�� ![]() CO2 ��g�� + H2 ��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������t2�� 850��, �ж������ǣ�
CO2 ��g�� + H2 ��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������t2�� 850��, �ж������ǣ�
���𰸡�
��1��0.03��
��2����0.5������������H2O��g��Ũ�ȡ�
��3������t2����ƽ�ⳣ��Ϊ2������850����ƽ�ⳣ��1��ƽ��������
��������
�����������1����ͼ��֪��4min��COŨ�ȱ仯��Ϊ��0.2-0.08��mol/L=0.12mol/L��
��v��CO��=![]() =0.03mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ�
=0.03mol/��L��min��������֮�ȵ��ڻ�ѧ������֮�ȣ�
��v��CO2��=v��CO��=0.03mol/��L��min�����ʴ�Ϊ��0.03��
��2����t1��ʱ��3min����ƽ��״̬����
CO��g��+H2O��g��![]() CO2��g��+H2��g��
CO2��g��+H2��g��
��ʼ��mol/L����0.20 0.30 0 0
ת����mol/L����0.1 0.1 0.1 0.1
ƽ����mol/L����0.1 0.2 0.1 0.1
��ƽ�ⳣ��K=![]() =
=![]() =0.5���ʴ�Ϊ��0.5��
=0.5���ʴ�Ϊ��0.5��
�����ݱ������ݣ���Ӧ��5min��6min������H2O��g��Ũ�ȣ�ƽ�������ƶ���ʹ��COŨ�ȼ�С���ʴ�Ϊ���ң�����H2O��g��Ũ�ȣ�
��3��850��ʱ�� CO��g��+H2O��g��![]() CO2��g��+H2 ��g��
CO2��g��+H2 ��g��
��ʼ��mol/L����0.20 0.30 0 0
ת����mol/L����0.12 0.12 0.12 0.12
ƽ����mol/L����0.08 0.18 0.12 0.12
ƽ�ⳣ��K=![]() =
=![]() =1��t2��ʱ����ѧ��ӦCO��g��+H2O��g��
=1��t2��ʱ����ѧ��ӦCO��g��+H2O��g��![]() CO2��g��+H2��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������K=
CO2��g��+H2��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������K=![]() =2��850����ƽ�ⳣ����ƽ�������ƶ���˵���¶Ƚ��ͣ��ʴ�Ϊ������t2����ƽ�ⳣ��Ϊ2������850����ƽ�ⳣ��1��ƽ�����ơ�
=2��850����ƽ�ⳣ����ƽ�������ƶ���˵���¶Ƚ��ͣ��ʴ�Ϊ������t2����ƽ�ⳣ��Ϊ2������850����ƽ�ⳣ��1��ƽ�����ơ�


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڷ�ӦX+2Y=R+2M�У���֪R��M��Ħ������֮��Ϊ22��9����1.6gX��Y��ȫ��Ӧ������4.4g R����˷�Ӧ��Y��M������֮��Ϊ�� ��
A��16��9 B��23��9 C��32��9 D��46��9
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��(2014����)���й��ڻ�ѧ����ı�ʾ��ȷ����
A���������Ƶĵ���ʽ��![]()
B��������Ϊ35��������Ϊ45����ԭ�ӣ�![]() Br
Br
C�������ӵĽṹʾ��ͼ��
D������ױ��Ľṹ��ʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȵ����⡣
��֪��CO(g)+H2O(g)![]() H2(g)+CO2(g)ƽ�ⳣ��K���¶ȵı仯���±���
H2(g)+CO2(g)ƽ�ⳣ��K���¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�ش���������
(1)�÷�Ӧ��ƽ�ⳣ������ʽK= ����H 0(�����������������=��)
(2)��֪��һ���¶��£�C(s)+CO2(g)![]() 2CO(g)ƽ�ⳣ��K1
2CO(g)ƽ�ⳣ��K1
C(s)+H2O(g)![]() H2(g)+CO(g)ƽ�ⳣ��K2��
H2(g)+CO(g)ƽ�ⳣ��K2��
��K��K1��K2��֮��Ĺ�ϵ�� ��
(3)800��ʱ����һ��10L�ĺ��ݷ�Ӧ���г���0.40molCO��1.60molˮ��������һ��ʱ ���Ӧ�ﵽƽ�⣬��ʱCO��ת����Ϊ �������������������䣬��ƽ����ϵ����ͨ��0.10molCO��0.40mol CO2����ʱv�� v�� (���������=������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ��д��ȷ��
A�������ȼ����Ϊ-890 kJ/mol�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)��H=-890 kJ/mol
B.��һ�������½�1 molSO2��0.5molO2�����ܱ������г�ַ�Ӧ���ų�����79.2kJ,��Ӧ���Ȼ�ѧ����ʽΪ��2SO2(g)��O2(g)![]() 2SO3(g) ��H=��158.4kJ��mol��1
2SO3(g) ��H=��158.4kJ��mol��1
C��NaOH(s)��1/2H2SO4(Ũ)=1/2Na2SO4(aq)��H2O(l) ��H=��57.3kJ��mol��1
D��2.00gC2H2������ȫȼ������Һ̬ˮ�Ͷ�����̼����ų�99.6kJ���������÷�Ӧ���Ȼ�ѧ����ʽΪ��2C2H2(g)��5O2(g)=4CO2(g)��2H2O(l) ��H=��2589.6kJ��mol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���á����������ش��������⣺
��1�����ԣ�H2CO3H2SiO3
��2�����ԣ�Mg��OH��2Al��OH��3
��3����̬�⻯���ȶ��ԣ�H2OH2S��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������(Na2S2O5)��һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5��ʵ�鲽�����£�
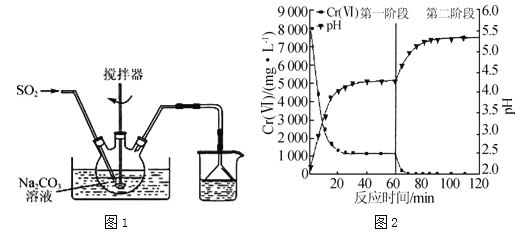
������Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
������̼���Ʒ�ĩ����pHΪ7��8��
������ͨSO2��pHΪ4.1��
�����ӹ�������Һ������Na2S2O5���壮
(1)�Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
(2)Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� ���������вⶨ��Һ��pH�ķ����� ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
(3)���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ(��ĥ��������ƿ)�У� ���ظ����ϲ���2�Σ���¼���ݣ�(ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI)
(4)������ˮ�г��������۸�[Cr(��)]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr(OH)3]=6.4��10��31��lg2��0.3��c(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й����л��������˵����ȷ����
A��2-������Ҳ���춡��
B����Ԫ��ϩ( )�뱽��Ϊͬ���칹��
)�뱽��Ϊͬ���칹��
C��C4H9Cl��3��ͬ���칹��
D������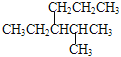 ����ȷ������2-��-3-��������
����ȷ������2-��-3-��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Na2CO3������������ǶԴ�����ò�ͬ���෨�ķ��ࡣ����ȷ����
A��Na2CO3�Ǽ� B��Na2CO3���� C��Na2CO3������ D��Na2CO3������
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com