
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4g R。则此反应中Y和M的质量之比为( )
A.16∶9 B.23∶9 C.32∶9 D.46∶9
 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案科目:高中化学 来源: 题型:
【题目】用①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤MgCl2 ⑥Ar ⑦CO2 ⑧CaF2 ⑨NH4Cl
⑩CaO2 ![]() Ca(ClO)2
Ca(ClO)2 ![]() N2H4等物质填空。
N2H4等物质填空。
(1)只存在离子键的是________(2) 由离子键和极性键构成的是_________
(3)由离子键和非极性键构成的是_________(4) 由极性键和非极性键构成的是_________
(5)写出下列物质的电子式:Na2S2:_________(NH4)2S:______
(6)写出下列物质的结构式:BCl3:_________ HClO:__________
(7)用电子式写出下列物质的形成过程:MgCl2:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是

A. 最简单气态氢化物的热稳定性Y>X>W>Z
B. 最高价氧化物对应水化物的酸性X>W>Z
C. 原子半径:W>Z>Y>X
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。

(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______,离子半径最小的是____(写元素符号)。
(2)J的简单离子的结构示意图__________。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______(写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列水溶液一定呈中性的是
A.由非电解质溶于水得到的溶液
B.[H+]、[OH–]均为5.0×10–7 mol·L–1的溶液
C.等物质的量的强酸与强碱反应得到的溶液
D.将pH=9的烧碱溶液稀释100倍所得到的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验的描述不正确的是( )
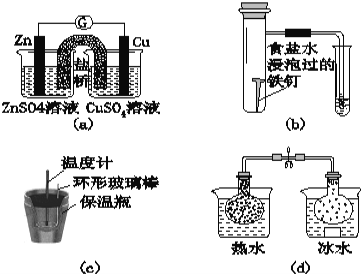
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)是放热反应
N2O4(g)是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮化钠(Na3N)是科学家制备的一种重要的化合物,它与水作用可产生NH3。请回答下列问题:
(1)Na3N的电子式是______,该化合物由______键形成。
(2)Na3N与盐酸反应生成________种盐,其电子式分别是________。
(3)Na3N与水的反应属于____________反应(填基本反应类型)。
(4)比较Na3N中两种粒子的半径:r(Na+)________r(N3-)(填“>”“=”或“<”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在一固定体积的容器中,通入一定量的CO和H2O,发生如下反应:CO (g) 十H2O (g) ![]() CO2 (g) 十 H2 (g) ; △H<0
CO2 (g) 十 H2 (g) ; △H<0
(1)在850℃时,CO和H2O浓度变化如下左图,则 0~4min的平均反应速率v(CO2)= _ mol·L-1·min-1

(2)t1℃时,在相同容器中发生上述反应,各物质的浓度变化如右上表:
① 计算t1℃该反应的平衡常数为K = 。
② t1℃时,反应在5min~6min间,平衡 移动(填向左、向右或不 ),若在第5分钟改变一种条件达到第6分钟的浓度,改变的条件是 。
(3)t2℃时,化学反应CO (g) + H2O (g) ![]() CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
CO2 (g) + H2 (g)的平衡浓度符合c(CO2)·c(H2)=2 c(CO)·c(H2O),则t2℃ 850℃, 判断依据是:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com