
【题目】对下列实验的描述不正确的是( )
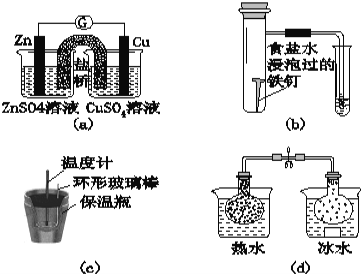
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)是放热反应
N2O4(g)是放热反应
科目:高中化学 来源: 题型:
【题目】在773 K,体积为V L的恒温恒容的容器中,硫和氧气可以发生如下转化,其反应过程和能量的关系如图1所示。其中状态III为平衡状态。

已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)在另一个温度和容积相同的容器中,1 mol SO2和2 mol O2充分反应,放出的热量比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)恒容条件下,对状态III采取下列措施,能使n(SO3)/n(SO2)增大的有 。
A.降低温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g) D.使用催化剂
(5)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 。
(6)图2中表示平衡混合物中SO3的含量最高的一段时间是 。

A. t1~t2 B. t3~t4 C. t5~t6 D. t6~t7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) △H>0的化学反应速率v与时间t的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0体系中各物质的浓度c随时间t的变化情况。下列说法中正确的是( )
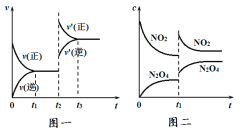
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大压强,则反应的△H增大
C.图二t1时改变的条件可能是升高了温度
D.图二t1时改变的条件是增大压强,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4g R。则此反应中Y和M的质量之比为( )
A.16∶9 B.23∶9 C.32∶9 D.46∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是 ( )
A.在原电池的负极和电解池的阴极上都发生失电子的氧化反应
B.用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1∶2
C.用惰性电极电解饱和NaCl溶液,若有0.1 mol电子转移,则生成0.1 mol NaOH
D.镀层破损后,镀锌铁板比镀锡铁板更易腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol某烃能与2mol HCl完全加成,其产物最多能被8mol Cl2完全取代,则原烃可能为
A. 乙炔 B. 环丁烯
C. 1一丙炔 D. 1,3一丁二烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014江苏)下列关于化学用语的表示正确的是
A.过氧化钠的电子式:![]()
B.质子数为35、中子数为45的溴原子:![]() Br
Br
C.硫离子的结构示意图:
D.间二甲苯的结构简式:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是一种食品添加剂.实验室用如图1所示装置制备Na2S2O5,实验步骤如下:
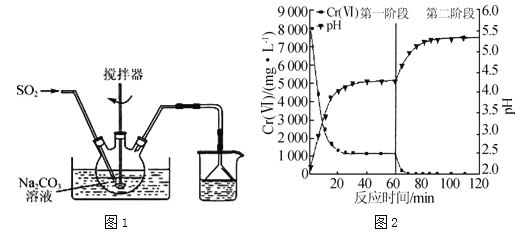
Ⅰ.在Na2CO3溶液中通入SO2至pH为4.1,生成NaHSO3溶液;
Ⅱ.加碳酸钠粉末调至pH为7~8;
Ⅲ.再通SO2至pH为4.1;
Ⅳ.从过饱和溶液中析出Na2S2O5晶体.
(1)制备焦亚硫酸钠总反应的化学方程式为 .
(2)Na2S2O5溶于水且与水能反应,所得溶液显酸性,其原因是 .步骤Ⅲ中测定溶液的pH的方法是 ;pH>4.1时,则产品中会有副产物,其化学式是 .
(3)利用碘量法可测定Na2S2O5产品中+4价硫的含量,实验方案为:将一定量的Na2S2O5产品放入碘量瓶(带磨口塞的锥形瓶)中, ,重复如上步骤2次,记录数据.(实验中必须使用的试剂有:c1molL﹣1的标准碘溶液、c2molL﹣1的标准Na2S2O3溶液、冰醋酸、淀粉溶液、蒸馏水;已知:2Na2S2O3+I2═Na2S4O6+2NaI)
(4)含铬废水中常含有六价铬[Cr(Ⅵ)].利用Na2S2O5和FeSO47H2O先后分两个阶段处理含Cr2O72﹣的废水,实验结果如图.
①实验过程中溶液的pH不断升高的原因是 .
②已知:Ksp[Cr(OH)3]=6.4×10﹣31,lg2≈0.3,c(Cr3+)<1.0×10﹣5molL﹣1时视为完全沉淀.现将废水中Cr2O72﹣全部转化为Cr(OH)3而除去,需调节溶液的pH范围为 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com