
����Ŀ������������(Na2S2O5)��һ��ʳƷ���Ӽ���ʵ��������ͼ1��ʾװ���Ʊ�Na2S2O5��ʵ�鲽�����£�
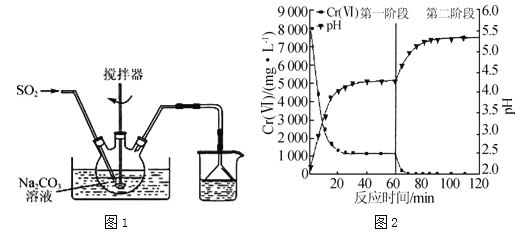
������Na2CO3��Һ��ͨ��SO2��pHΪ4.1������NaHSO3��Һ��
������̼���Ʒ�ĩ����pHΪ7��8��
������ͨSO2��pHΪ4.1��
�����ӹ�������Һ������Na2S2O5���壮
(1)�Ʊ������������ܷ�Ӧ�Ļ�ѧ����ʽΪ ��
(2)Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ���� ���������вⶨ��Һ��pH�ķ����� ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ�� ��
(3)���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ�����ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ(��ĥ��������ƿ)�У� ���ظ����ϲ���2�Σ���¼���ݣ�(ʵ���б���ʹ�õ��Լ��У�c1molL��1�ı�����Һ��c2molL��1�ı�Na2S2O3��Һ�������ᡢ������Һ������ˮ����֪��2Na2S2O3+I2�TNa2S4O6+2NaI)
(4)������ˮ�г��������۸�[Cr(��)]������Na2S2O5��FeSO47H2O�Ⱥ�������δ�����Cr2O72���ķ�ˮ��ʵ������ͼ��
��ʵ���������Һ��pH�������ߵ�ԭ���� ��
����֪��Ksp[Cr(OH)3]=6.4��10��31��lg2��0.3��c(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ�������ֽ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪ ��
���𰸡�(1)Na2CO3+2SO2�TNa2S2O5+CO2��
(2)Na2S2O5��ˮ��Ӧ����NaHSO3��NaHSO3��ˮ�е���ʹ��Һ�����ԣ���pH��(����ȼƣ���pH������)�ⶨ��Na2SO3��
(3)����һ������Ĺ�����c1molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ��������
(4)��Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+��ʹ��Һ��pH�����pH��5.6��
��������(1).�ɽ��������Ƶ��Ʊ����̿�֪�������Ķ��Ƿ�������ԭ��Ӧ����Ӧ����̼���ƺͶ�������������Ϊ���������ƺͶ�����̼�����������غ���ƽ��ɵã� Na2CO3+2SO2�TNa2S2O5+CO2
(2). Na2S2O5����ˮ����ˮ�ܷ�Ӧ��������Һ�����ԣ���ԭ����Na2S2O5��ˮ��Ӧ����NaHSO3��NaHSO3��ˮ������ʹ��Һ�����ԣ��������вⶨ��Һ��pH�ķ�������pH�ƣ�����ȼƣ���pH���������ⶨ��pH��4.1ʱ�����Ʒ�л��и�����仯ѧʽ��Na2SO3 ��
(3). ���õ������ɲⶨNa2S2O5��Ʒ��+4����ĺ������������ṩ���Լ��������ȼӹ����ı���Һ����������������Ϊ�����ƣ�Ϊ��ǿ��Һ�������ԣ�Ҫ���������ı�������õ�����ָʾ�����������������Һ�ζ������ĵ⣬���ݱ���Һ����������Ƶ�����������������Ƶĺ�������һ�����������+4��S�ĺ�������Ϊ�˼��ٵζ���Ҫ��������������ˮ��ʵ�鷽��Ϊ����һ������Na2S2O5��Ʒ�������ƿ�У�����һ������Ĺ�����c1molL��1�ı�����Һ���ټ��������ı����������ˮ����ַ�Ӧһ��ʱ�䣬���������Һ����c2molL��1��Na2S2O3��Һ�ζ�����Һ����ɫǡ�ñ�Ϊ��ɫ���Ұ�����ڲ���ɫ���������ظ����ϲ���2�Σ���¼���ݣ�
(4). ��ʵ������з��������ӷ�ӦΪ��3S2O32-+4Cr2O72-+26H+=6SO42-+8Cr3++13H2O��6Fe2++Cr2O72-+14H+=6Fe3++2Cr3++7H2O,������Һ��pH�������ߵ�ԭ����Na2S2O5��FeSO47H2O��Cr2O72����Ӧʱ������H+��ʹ��Һ��pH�����
���ɳ����ܽ�ƽ��Cr(OH)3![]() Cr3++3OH-��֪����Ϊc(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ����,����c(OH-)>
Cr3++3OH-��֪����Ϊc(Cr3+)��1.0��10��5molL��1ʱ��Ϊ��ȫ����,����c(OH-)>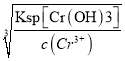 =
=![]() =4.0
=4.0![]() mol/L����pH>5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪpH��5.6��
mol/L����pH>5.6�����Խ���ˮ��Cr2O72��ȫ��ת��ΪCr(OH)3����ȥ���������Һ��pH��ΧΪpH��5.6��


 ������ҵ����ν�����������ϵ�д�
������ҵ����ν�����������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�����������ȷ���ǣ� ��
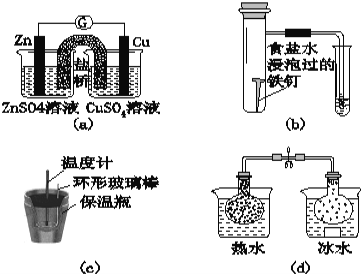
A��ͼ��a����ʾ��ʵ�飺���ݼ����ƣ�G����ָ��ƫת�ķ���Ƚ�Zn��Cu�Ľ���������
B��ͼ��b����ʾ��ʵ�飺����С�Թ���Һ��ı仯�ж������������ⸯʴ
C��ͼ��c����ʾ��ʵ�飺�����¶ȼƶ����ı仯��ϡ�����ϡNaOH��Һ��Ӧ�ⶨ�к���
D��ͼ��d����ʾ��ʵ�飺��������ƿ��������ɫ�ı仯�ж�2NO2��g��![]() N2O4��g���Ƿ��ȷ�Ӧ
N2O4��g���Ƿ��ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������Ԫ�ص�����![]() ��
��![]() ��
��![]() ��
��![]() ��a ��b��c��dΪԪ�ص�ԭ�������������Ǿ�����ͬ�ĵ��Ӳ�ṹ����m > n����������������ж���ȷ����
��a ��b��c��dΪԪ�ص�ԭ�������������Ǿ�����ͬ�ĵ��Ӳ�ṹ����m > n����������������ж���ȷ����
�� a-b=m-n ��Ԫ�ص�ԭ������a> b��c��d
��Ԫ�طǽ�����Z > R ������������Ӧˮ����ļ���X > Y
A. �ڢ� B. �� C. �٢ڢۢ� D. �٢ڢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£���һ�̶�����������У�ͨ��һ������CO��H2O���������·�Ӧ��CO ��g�� ʮH2O ��g�� ![]() CO2 ��g�� ʮ H2 ��g�� �� ��H��0
CO2 ��g�� ʮ H2 ��g�� �� ��H��0
��1����850��ʱ��CO��H2OŨ�ȱ仯������ͼ���� 0��4min��ƽ����Ӧ����v��CO2���� _ mol��L-1��min-1

��2��t1��ʱ������ͬ�����з���������Ӧ�������ʵ�Ũ�ȱ仯�����ϱ���
�� ����t1���÷�Ӧ��ƽ�ⳣ��ΪK = ��
�� t1��ʱ����Ӧ��5min��6min�䣬ƽ�� �ƶ������������һ� �������ڵ�5���Ӹı�һ�������ﵽ��6���ӵ�Ũ�ȣ��ı�������� ��
��3��t2��ʱ����ѧ��ӦCO ��g�� + H2O ��g�� ![]() CO2 ��g�� + H2 ��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������t2�� 850��, �ж������ǣ�
CO2 ��g�� + H2 ��g����ƽ��Ũ�ȷ���c��CO2����c��H2����2 c��CO����c��H2O������t2�� 850��, �ж������ǣ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ�������Ӧ�ò����Ӧ����
A��Na2O2�ֱܷ���H2O��CO2��Ӧ����������������������
B���轺��ס���ˮ����ǿ����������װʳƷ�ĸ����
C��K2FeO4����ǿ��ԭ���ұ���������Fe3����������ˮ�������;�ˮ
D��Һ������ʱ�����մ������ȣ�ʹ��Χ�¶ȼ��罵�ͣ���˿����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ʊ���Һ�治���������������Ķ�����̼������1%��NaOHת��ΪNa2CO3���Դ�NaOH��Һ�ζ�δ֪Ũ�ȵ����ᣬѡ�ü�����ָʾ��������Ũ�ȵIJⶨ����ᣨ ��
A��ƫ��1% B��ƫ��1% C����Ӱ�� D��ƫ��0.1%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�����ܱ������У�Ͷ��һ������A�������淴Ӧ��A(s)![]() B(g)+C(g)����H=��Q kJ/mol(Q>O)��һ��ʱ���Ӧ�ﵽƽ�⣬Ȼ����С������������´ﵽƽ�⡣���з�������ȷ����
B(g)+C(g)����H=��Q kJ/mol(Q>O)��һ��ʱ���Ӧ�ﵽƽ�⣬Ȼ����С������������´ﵽƽ�⡣���з�������ȷ����
A������ƽ��ʱ��C(g)��Ũ�����
B��ƽ��ʱ����λʱ����n(B)������n(C)����=1��1
C��������ƽ����ϵ�м�������A��ƽ�ⲻ�ƶ�
D������ʼʱ�������м���1 mol B��1 mol C����ﵽƽ��ʱ����QkJ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����й��̲��漰��ѧ�仯����
A. �ô����ȥˮ�� B. ��KClO3�Ʊ�O2
C. ��Ư��Ư������ D. �þƾ������Ӳ�Ʒ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25��ʱ��AgCl�İ�ɫ����Һ�У����μ����Ũ�ȵ�KI��Һ��Na2S��Һ���۲쵽���������ȳ��ֻ�ɫ���������ճ��ֺ�ɫ��������֪�й����ʵ��ܶȻ�Ksp ��25�������£�
AgCl | AgI | Ag2S | |
Ksp����λʡ���� | 1.8��10-10 | 1.5��10-16 | 6.3��10-50 |
����������������
A������ת����ʵ�ʾ��dz����ܽ�ƽ����ƶ�
B���ܽ��С�ij�������ת��Ϊ�ܽ�ȸ�С�ij���
C��AgCl�����ڵ����ʵ���Ũ�ȵ�NaCl��CaCl2��Һ�е��ܽ�̶���ͬ
D��25��ʱ���ڱ���AgCl��AgI��Ag2S��Һ�У�����Ag+��Ũ�Ȳ�ͬ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com