
【题目】在773 K,体积为V L的恒温恒容的容器中,硫和氧气可以发生如下转化,其反应过程和能量的关系如图1所示。其中状态III为平衡状态。

已知:2SO2(g)+O2(g)![]() 2SO3(g) ΔH=-196.6 kJ/mol。
2SO3(g) ΔH=-196.6 kJ/mol。
请回答下列问题:
(1)写出表示硫的燃烧热的热化学方程式: 。
(2)状态II到状态III放出的热量为 。
(3)在另一个温度和容积相同的容器中,1 mol SO2和2 mol O2充分反应,放出的热量比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)恒容条件下,对状态III采取下列措施,能使n(SO3)/n(SO2)增大的有 。
A.降低温度
B.充入He气
C.再充入1 mol SO2(g)和1 mol O2(g) D.使用催化剂
(5)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2(g)的量,则图中t2时引起平衡移动的条件可能是 。
(6)图2中表示平衡混合物中SO3的含量最高的一段时间是 。

A. t1~t2 B. t3~t4 C. t5~t6 D. t6~t7
【答案】(1)S(s)+O2(g)=SO2(g)△H=-297kJ·mol-1;
(2)78.64kJ;(3)大;(4)AC;(5)增大压强;(6)B。
【解析】
试题分析:(1)S的燃烧生成是SO2,因此硫燃烧热的热化学反应方程式为:S(s)+O2(g)=SO2(g) △H1=-297kJ·mol-1;(2)根据图像,消耗0.8molSO2,应放出热量0.8×196.6/2kJ=78.64kJ;(3)相当于在(2)的基础上再通入1molO2,增大反应物的浓度,平衡向正反应方向移动,放出的热量比∣ΔH2∣大;(4)A、正反应是放热反应,根据勒夏特列原理,降低温度,平衡向正反应方向移动,n(SO3)增大,n(SO2)降低,因此比值增大,故正确;B、恒容状态下,充入非反应气体,组分的浓度不变,化学平衡不移动,比值不变,故错误;C、再充入1molSO2和1molO2,相当于在原来基础上增大压强,平衡向正反应方向移动,n(SO3)增大,n(SO2)降低,比值增大,故正确;D、使用催化剂,化学平衡不移动,比值不变,故错误;(5)t2时刻,正逆反应速率都增大,可能是增大压强或升高温度,增大压强,平衡向正反应方向移动,即v正>v逆,因此此时刻是增大压强,如果是升高温度,正反应方向是放热反应,升高温度,平衡向逆反应方向进行,即v逆>v正,故此时刻是增大压强;(6)SO3含量最高,说明反应是向正反应方向移动,即选项B正确。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:![]() ,有关该平衡体系的说法正确的是( )
,有关该平衡体系的说法正确的是( )
A.升高温度,W(g)体积分数增加,则正反应是放热反应
B.减小X浓度,平衡向逆反应方向移动,平衡常数K减小
C.平衡正向移动,化学平衡常数一定增大
D.该反应可表示为X(g) + 2Y(g)![]() 2Z(g) + 2W(g)
2Z(g) + 2W(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:

(1)当电极a为Al,电极b为Cu,电解质溶液为稀硫酸时,正极的电极反应式为:___________。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该装置______(填“能”或“不能”)
形成原电池,若不能,请说明理由;若能,请指出正、负极材料:__________。当反应中收集到标准状况下224mL气体时,消耗的电极质量为________g。
(3)燃料电池工作原理是将燃料和氧化剂(如O2)反应产生的化学能直接转化为电能。现设计一燃料电池,以电极a为正极,电极b为负极,甲烷为燃料,采用氢氧化钠溶液为电解液;则甲烷应通入____极(填a或b,下同),电子从____极流出,电解质溶液中OH-向____极移动。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用①H2O ②H2O2 ③Ba(OH)2 ④Na2O2 ⑤MgCl2 ⑥Ar ⑦CO2 ⑧CaF2 ⑨NH4Cl
⑩CaO2 ![]() Ca(ClO)2
Ca(ClO)2 ![]() N2H4等物质填空。
N2H4等物质填空。
(1)只存在离子键的是________(2) 由离子键和极性键构成的是_________
(3)由离子键和非极性键构成的是_________(4) 由极性键和非极性键构成的是_________
(5)写出下列物质的电子式:Na2S2:_________(NH4)2S:______
(6)写出下列物质的结构式:BCl3:_________ HClO:__________
(7)用电子式写出下列物质的形成过程:MgCl2:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学与生活的认识正确的是( )
A. 安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率
B. 新鲜蔬菜做熟后,所含维生素C不会有损失
C. 常温下铝遇浓硝酸钝化,可用铝罐车运输浓硝酸
D. “天宫一号”使用的碳纤维,是一种新型有机高分子材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表中有A、B、C三种原子序数依次增大的元素,A是地壳中含量最多的金属元素,B的价层电子排布为nsn-1npn+1,C是生活中的一种常用金属且其原子的外围电子排布为3d104s1。

(1)A基态原子的电子排布式为__________________。
(2)一氧化碳(与N2互为等电子体)分子中σ键与π键数目之比为________。
(3)C的单质和某化合物甲的微观部分结构分别如图所示,C微粒周围等距离且距离最近的C微粒有________个;甲的化学式为________(用M、N表示)。
(4)金属C在加热时与B的最高价氧化物对应水化物的浓溶液反应的化学方程式为____________。
(5)C元素的最高价氧化物的水化物能溶于氨水,该反应的化学方程式为__________________。
(6)联氨(N2H4)是航天飞船常用的高能燃料,可以用尿素为原料制取,方法是在KMnO4催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、NaOH溶液反应生成联氨、Na2CO3、H2O及另外一种产物,写出该反应的化学方程式:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W在元素周期表中的相对位置如下图所示,其中W原子的质子数是其最外层电子数的三倍,下列说法不正确的是

A. 最简单气态氢化物的热稳定性Y>X>W>Z
B. 最高价氧化物对应水化物的酸性X>W>Z
C. 原子半径:W>Z>Y>X
D. 元素X、Z、W的最高化合价分别与其主族序数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列实验的描述不正确的是( )
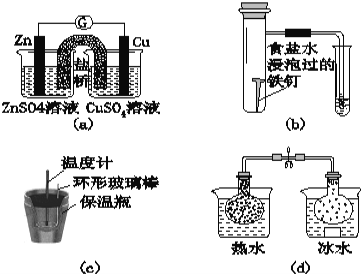
A.图(a)所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性
B.图(b)所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀
C.图(c)所示的实验:根据温度计读数的变化用稀盐酸和稀NaOH溶液反应测定中和热
D.图(d)所示的实验:根据两烧瓶中气体颜色的变化判断2NO2(g)![]() N2O4(g)是放热反应
N2O4(g)是放热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com