
【题目】下表是元素周期表的一部分,列出11种元素在周期表中的位置,填写下列空白。

(1)第三周期元素中,原子半径最大的元素是(稀有气体除外)______,离子半径最小的是____(写元素符号)。
(2)J的简单离子的结构示意图__________。
(3)D、E、F、K四元素的最高价氧化物对应水化物,按碱性依次减弱顺序排列为(写化学式)____。
(4)比较G、H两元素的最高价氧化物对应水化物的酸性______(写化学式,下同)。比较C、G两元素的气态氢化物稳定性_________。
【答案】 Na Al 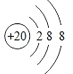 KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4>H2SO4 H2O>H2S
KOH>NaOH>Mg(OH)2>Al(OH)3 HClO4>H2SO4 H2O>H2S
【解析】由元素在周期表中位置,可知A为氢,B为碳,C为氧,D为Na,E为Mg,F为Al,G为硫,H为Cl,I为Ar,K为钾,J为Ca。
(1)同周期自左而右原子半径减小,故第三周期中Na原子半径最大;电子层结构相同的离子,核电荷数越大离子半径越小,离子电子层越多离子半径越大,离子半径最小为Al3+;故答案为:Na;Al;
(2)J的简单离子为Ca2+,离子核外电子数为18,离子结构示意图为: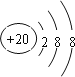 ,故答案为:
,故答案为: ;
;
(3)同周期自左而右金属性减弱,同主族自上而下金属性增强,金属性越强,最高价氧化物对应水化物的碱性越强,按碱性依次减弱顺序排列为:KOH>NaOH>Mg(OH)2>Al(OH)3,故答案为:KOH>NaOH>Mg(OH)2>Al(OH)3;
(4)非金属性Cl>S,故酸性HClO4>H2SO4,非金属性O>S,氢化物稳定性:H2O>H2S,答案为:HClO4>H2SO4;H2O>H2S。


 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:
【题目】小明体检的血液化验单中,葡萄糖为5.9 mmol/L。表示该体检指标的物理量是( )。
A.溶解度(s) B.物质的量浓度(c) C.质量分数(%) D.摩尔质量(M)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用某种仪器量取液体体积时,平视时读数为nmL,仰视时读数为x mL,俯视时读数为y mL,若x>n>y,则所用的仪器可能为
A. 量筒 B. 容量瓶 C. 滴定管 D. 以上均不对
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的分离方法不正确的是 ( )
A.用过滤的方法除去食盐中泥沙
B.用蒸馏的方法将自来水制成蒸馏水
C.用酒精萃取碘水中的碘
D.用水冲洗的方法从沙里淘金
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图一表示的是可逆反应CO(g)+H2(g) C(s)+H2O(g) △H>0的化学反应速率v与时间t的关系,图二表示的是可逆反应2NO2(g) N2O4(g) △H<0体系中各物质的浓度c随时间t的变化情况。下列说法中正确的是( )
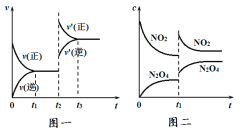
A.图一t2时改变的条件可能是升高了温度或增大了压强
B.图一t2时改变的条件是增大压强,则反应的△H增大
C.图二t1时改变的条件可能是升高了温度
D.图二t1时改变的条件是增大压强,混合气体的平均相对分子质量减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上一般可采用如下反应来合成甲醇(于固定容器中进行):2H2(g) + CO(g)![]() CH3OH(g)
CH3OH(g)
(1)下表所列数据是该反应在不同温度下的化学平衡常数(K)

①该反应的熵变△S 0(填:“<,>,=”)。该反应在 (填:高温或低温)条件下能自发进行。
②要提高CO的转化率,可以采取的措施是_____________(填序号)。
a.升温
b.加入催化剂
c.增加CO的浓度
d.加入H2加压
e.加入惰性气体加压
f.分离出甲醇
(2)如图表示在温度分别为T1、T2时,平衡体系中H2的体积分数随压强变化曲线,A、C两点的反应速率A__________C(填“>”、“=”或“<”,下同),A、C两点的化学平衡常数A___________C,由状态B到状态A,可采用___________的方法(填“升温”或“降温”)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在反应X+2Y=R+2M中,已知R和M的摩尔质量之比为22∶9,当1.6gX与Y完全反应后,生成4.4g R。则此反应中Y和M的质量之比为( )
A.16∶9 B.23∶9 C.32∶9 D.46∶9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】煤化工中常需研究不同温度下平衡常数、投料比等问题。
已知:CO(g)+H2O(g)![]() H2(g)+CO2(g)平衡常数K随温度的变化如下表:
H2(g)+CO2(g)平衡常数K随温度的变化如下表:
温度/℃ | 400 | 500 | 800 |
平衡常数K | 9.94 | 9 | 1 |
回答下列问题
(1)该反应的平衡常数表达式K= ,△H 0(填“<”、“>”、“=”)
(2)已知在一定温度下,C(s)+CO2(g)![]() 2CO(g)平衡常数K1
2CO(g)平衡常数K1
C(s)+H2O(g)![]() H2(g)+CO(g)平衡常数K2,
H2(g)+CO(g)平衡常数K2,
则K、K1、K2,之间的关系是 。
(3)800℃时,向一个10L的恒容反应器中充入0.40molCO和1.60mol水蒸气,经一段时 间后反应达到平衡,此时CO的转化率为 ;若保持其他条件不变,向平衡体系中再通入0.10molCO和0.40mol CO2,此时v正 v逆 (填“>”、“=”或“<”).
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com