
【题目】实验室常用石灰石和稀盐酸制取二氧化碳。
探究一 气体发生装置的选择

(1)写出图中带标号仪器的名称:a_____________;b_______________。
(2)实验室制取二氧化碳气体,发生和收集装置分别选用______ 和______ (填字母),检验集满的方法是___________________________________。
探究二 药品的选择
小明对三组药品进行了研究,实验记录如下:
组别 | 药 品 | 实验现象 |
① | 块状石灰石和稀盐酸 | 产生气泡速率适中 |
② | 块状石灰石和稀硫酸 | 产生气泡速率缓慢并逐渐停止 |
③ | 粉末状石灰石和稀盐酸 | 产生气泡速率很快 |
(3)对照实验①③,是探究_____________________对产生二氧化碳速率的影响;
(4)对照实验______,是探究不同的酸对产生二氧化碳速率的影响;
(5)小明选择第①组药品来制取二氧化碳,该组反应的化学方程式为___________。
探究三 生成二氧化碳量的测定
实验室常通过下列两种途径测量生成二氧化碳的量
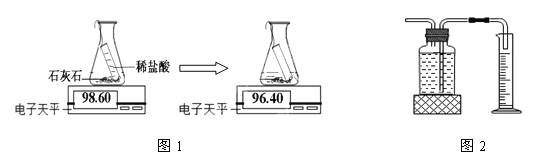
(6)途径一(如图1):由图可知产生二氧化碳的质量为________g。
途径二(如图2):通过排水法测得生成二氧化碳的体积。
(7)由上两种途径比较,你认为哪种途径实验结果更为准确,理由是___________________。
【答案】 试管 集气瓶 B D 燃着的木条放在集气瓶口,若熄灭则集满 药品的状态(或接触面积) ①② ![]() 2.2 途径一更准确,途径二中部分二氧化碳溶于水
2.2 途径一更准确,途径二中部分二氧化碳溶于水
【解析】(1)写出图中带标号仪器的名称:a试管、b集气瓶;(2)实验室制取二氧化碳气体,固体和液体不加热,发生装置选用B;CO2密度比空气大,用向上排空法收集,故选D装置;检验集满的方法是:燃着的木条放在集气瓶口,若熄灭则集满;(3)对照实验①块状石灰石和稀盐酸③粉末状石灰石和稀盐酸,是探究药品的状态(或接触面积)对产生二氧化碳速率的影响;(4)对照实验 ①稀盐酸②稀硫酸,是探究不同的酸对产生二氧化碳速率的影响;(5)小明选择第①组药品:块状石灰石和稀盐酸,方程式为![]() ;(6)途径一(如图1):由图可知产生二氧化碳的质量为98.60g-96.40g=2.2g;(7)由上两种途径比较,实验结果是途径一更准确,途径二中部分二氧化碳溶于水。
;(6)途径一(如图1):由图可知产生二氧化碳的质量为98.60g-96.40g=2.2g;(7)由上两种途径比较,实验结果是途径一更准确,途径二中部分二氧化碳溶于水。


科目:高中化学 来源: 题型:
【题目】曾有制药厂违反规定,购入工业用“二甘醇”代替医用丙二醇(C2H8O2)作辅料,用于“亮菌甲素注射液”的生产,导致多名患者肾功能衰歇而死亡。二甘醇又称乙二醇醚,分子式为C4H10O3(HO-CH2-CH2-O-CH2-CH2-OH),二甘醇是一种重要的化工原料,用途十分广泛。二甘醇一般的合成路线为:

请回答下列问题:
(1)下列关于“丙二醇和“二甘醇”及“乙二醇”的有关说法正确的是____________
A.丙二醇是乙二醇的同系物
B.它们具有相同种类和数目的官能团,性质上完全相同
C.“丙二醇”和“二甘醇”在病人体内都能被氧化为草酸
D.分离“丙二醇”和“二甘醇”可采用分液的方法
(2)过程I是石油加工中常用步骤,其名称为_______。
(3)从物质B到物质C的过程如果条件控制不好会生成物质E,E可用于金属的切割,写出实验室制备E的化学方程式___________,则为了能得到二甘醇D,物质B到物质C的反应条件是_________,该反应属于________(填反应类型)。写出B可能生成E的化学方程式______。
(4)反应Ⅲ的化学方程式为:____________。
(5)A的一种同系物结构简式为 请用系统命名法对其命名_______________。
请用系统命名法对其命名_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】绿矾(![]() )是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
)是治疗缺铁性贫血的特效药。某化学兴趣小组对绿矾进行了如下的探究:
I .【制备产品】
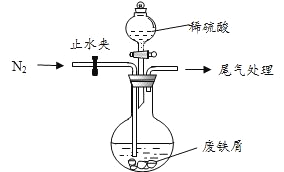
该小组由废铁屑(含少量氧化铜、氧化铁等杂质),用上图所示装置制备![]() 晶体,步骤如下:
晶体,步骤如下:
(1)预处理:先将废铁屑加入到饱和![]() 溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
溶液中洗涤,目的是_____,然后将废铁屑用水洗涤2~3 遍。
(2)将洗涤后的废铁屑加入到圆底烧瓶中,并持续通入![]() ,
,![]() 的作用是________。
的作用是________。
(3)再加入足量稀硫酸,控制温度 50℃~80℃之间,充分反应后,圆底烧瓶中剩余的固体为_____________。
(4)获取产品:先向步骤(3)中反应后的混合物中加入少许蒸馏水,趁热过滤, ____________。
滤出晶体,用少量冰水洗涤 2~3 次,再用滤纸将晶体吸干,密闭保存。
II.【测定![]() 含量】
含量】
(1)称取上述样品 10.0g,溶于适量的稀硫酸中,配成 100mL 溶液,需要的仪器除天平、胶头滴管、 烧杯、量筒外,还需要的仪器有(填仪器名称)____________________、_______________________。
(2)准确量取 25mL 该液体于锥形瓶中,用 0.1000mol/L ![]() 标准溶液滴定,则滴定终点的判断方法是________________________。
标准溶液滴定,则滴定终点的判断方法是________________________。
(3)用同样的方法滴定 3 次,平均消耗 10.00mL 标准液,该样品中![]() 的质量分数为____________。(已知 Mr(
的质量分数为____________。(已知 Mr(![]() )=278)
)=278)
(4)若测量结果偏小,则可能是在定容时_________________(填“俯视”或“仰视”)读数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学利用如图所示实验装置测定常温常压下的气体摩尔体积。
根据下列步骤完成实验:
①装配好装置,检查气密性
②用砂纸擦去镁带表面的氧化物,然后取0.0480g的镁带加入仪器a中,分液漏斗内加入足量1mol/L硫酸溶液
③量气装置中加入适量水,记录量气管读数(读数为0.10mL)
④通过分液漏斗向仪器a中加入适量硫酸溶液,使镁带与硫酸充分反应
⑤当镁带完全反应后,再次记录量气管读数(读数为49.60mL)。

完成下列填空:
(1)仪器a的名称_______,通过分液漏斗向仪器a中加入硫酸溶液的操作是_______。
(2)在记录量气管读数时,应注意将_______,再________,视线与量气管内凹液面相切,水平读数。
(3)该同学测出此条件下气体摩尔体积为__________,测定结果比理论值偏大,可能的原因是(填字母代号)__________。
a.镁带中氧化膜未除尽 b.镁带含有杂质铝
c.③记录量气管读数时俯视读数 d.镁带完全反应后有残留的未溶固体
(4)与原方案装置相比,有同学设想用装置B代替装置A,实验精确度更高。请说明理由____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有属于前四周期的A、B、C、D、E、F、G七种元素,原子序数依次增大。A元素的价电子构型为nsnnpn+1;C元素为最活泼的非金属元素,D元素核外有三个电子层,最外层电子数是核外电子总数的1/6;E元素正三价离子的3d轨道为半充满状态,F元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子;G元素与A元素位于同一主族,其某种氧化物有剧毒。
(1)A元素的第一电离能 B元素的第一电离能(填“<”“>”或“=”),A、B、C三种元素电负性由小到大的顺序为 (用元素符号表示)。
(2)D元素原子的价电子排布式是 。
(3)C元素的电子排布图为 ;E3+的离子符号为 。
(4)F元素位于元素周期表的 区,其基态原子的电子排布式为 。
(5)G元素可能的性质 。
A.其单质可作为半导体材料
B.其电负性大于磷
C.最高价氧化物对应的水化物是强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下列装置进行相应实验,能达到实验目的的是

图1 图2 图3 图4
A. 图1所示装置制取并收集氨气
B. 图2所示装置用于制备并收集NO气体
C. 图3所示装置用于除去碳酸氢钠固体中的少量碳酸钠
D. 图4所示装置用于Na2CO3和稀H2SO4反应制取少量的CO2气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从古至今,铁及其化合物在人类生产、生活中的作用发生了巨大的变化。
(1)现代工业“接触法制硫酸”用黄铁矿(主要成分为FeS2)为原料。测得硫酸渣的化学成分为:SiO2约45%,Fe2O3约40%,Al2O3约10%,MgO约5%。用该废渣制取药用辅料——红氧化铁的工艺流程如下(部分操作和条件略):

请回答下列问题:
①在步骤i中产生的有毒气体可能有___________________。
②在步骤iii操作中,要除去的离子之一为Al3+,若常温时Ksp[Al(OH)3]=1.0×10-32,此时理论上将Al3+沉淀完全,则溶液的pH为_________(注:c(Al3+)≤10-5mol·L-1视为沉淀完全)。
③步骤ⅳ中,洗涤沉淀的操作是___________________。
生成FeCO3的离子方程式是__________________。
(2)氯化铁溶液称为化学试剂中的“多面手”,向氯化铜和氯化铁的混合溶液中加入氧化铜粉末会产生新的沉淀,写出该沉淀的化学式_____________。请用平衡移动的原理,结合必要的离子方程式,对此现象作出解释:______________________。
(3)古老而神奇的蓝色染料普鲁士蓝的合成方法如下:

复分解反应ⅱ的离子方程式是________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知CO和H2的混合气体称为水煤气,可由碳与水蒸气在高温下反应生成。如下图:

已知:单质E可作为半导体材料,化合物F是有毒的氧化物,C常温下为液态。据此,请填空:(用化学式回答)
(1)氧化物A是_____________
(2)化合物F是___________
(3)反应②的化学方程式是_____________________________________
(4)反应③的化学方程式是_____________________________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com