
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物对应的水化物中酸性较强的是____(写出化学式)。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程:___。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ 的热量,请写出表示X2燃烧热的热化学方程式:_____。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为___;若B为常见家用消毒剂的主要成分,则B的化学式是___。
【答案】HClO4![]() H2(g)+
H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-2a kJ·mol-1H2O2+H2S
H2O(l) ΔH=-2a kJ·mol-1H2O2+H2S![]() S↓+2H2O离子键、(极性)共价键NaClO
S↓+2H2O离子键、(极性)共价键NaClO
【解析】
X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大,Y原子最外层电子数与核外电子总数之比为3∶4,则Y为氧元素;M原子最外层电子数与次外层电子数之比为3∶4,则M为硫元素;因为上述均为短周期主族元素且原子序数M>N,则N为氯元素;N-、Z+、X+离子的半径逐渐减小,化合物XN常温下为气体,则X为氢元素、Z为钠元素。
由上述分析可知X、Y、Z、M、N分别为:H、O、Na、S、Cl元素。
(1)S、Cl的最高价氧化物对应的水化物分别为H2SO4和HClO4,酸性较强的是HClO4。
(2)Na和S形成常见化合物为Na2S,是离子化合物,用电子式表示其形成过程为:![]() 。
。
(3)1g H2在O2中完全燃烧放出a kJ 的热量,则1molH2在O2中完全燃烧放出2a kJ 的热量,其热化学方程式为:H2(g)+![]() O2(g)
O2(g)![]() H2O(l) ΔH=-2a kJ·mol-1。
H2O(l) ΔH=-2a kJ·mol-1。
(4)H与O、H与S形成的18电子分子分别为:H2O2和H2S,二者在水溶液中反应有黄色沉淀(硫)生成,化学方程式为:H2O2+H2S![]() S↓+2H2O。
S↓+2H2O。
(5)H、O、Na、S、Cl五种元素中的任意三种元素组成的强电解质A、B,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,可能为:NaOH、NaHS、NaClO等,A溶液中水的电离程度比在纯水中小,则A为NaOH,其中的化学键类型为:离子键、(极性)共价键;若B为常见家用消毒剂的主要成分,则B的化学式为:NaClO。


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. H2O+SO3=H2SO4 B. CH4+2O2![]() CO2+2H2O
CO2+2H2O
C. 2Fe(OH)3![]() Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
B. 某密闭容器中 0.1 mol N2和 0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6NA
C. 50 mL 18.4 mol/L 浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D. 常温常压下,1 mol O2与SO2的混合气体中含氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波义耳在《怀疑的化学家》一书中说:“在火的单独作用下,玻璃容器的水银会丧失其原有的银色,变成一种红色物体;而无须使用任何附加试剂,用这种红色物体也可以得到汞”。 该过程可表示为"2Hg+O2![]() 2HgO”下列说法错误的是
2HgO”下列说法错误的是
A. 利用该反应可粗略测定空气中氧气的含量
B. 波义耳所描述的上述变化是一个可逆的化学反应
C. 水银温度计如果破损,可将硫粉洒在散落的水银上防止污染
D. 制备Hg单质可以采用热分解法使其氧化物在高温下分解制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H和O可以形成H2O和H2O2两种化合物,试根据有关信息完成下列问题:
(1)水是维持生命活动所必需的一种物质。
①1 mol冰中有____mol氢键。
②用球棍模型表示的水分子结构是____。


(2)已知H2O2分子的结构如图所示。H2O2分子不是直线形的,两个氢原子犹如在半展开的书的两面上,两个氧原子在书脊位置上,书页夹角为93°52',而两个O—H键与O—O键的夹角均为96°52'。

试回答:
①H2O2分子的电子式是______,结构式是______。
②H2O2分子是含有___(填“极性”或“非极性”,下同)键和__键的___分子。
③H2O2难溶于CS2,简要说明理由:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)是一种优良的消毒剂,熔点为-59℃,沸点为 11℃,浓度过高时易发生分解,甚至爆炸。某课外兴趣小组通过氯气与 NaClO2溶液反应来制取少量ClO2,装置如下图所示:
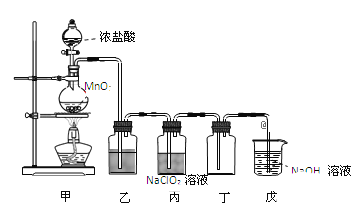
(1)甲装置中圆底烧瓶内发生反应的化学方程式是_________________________________________。
(2)丙装置中发生的反应可能经两步完成,请将其补充完整:
①____________________________________________(用化学方程式表示),
②HClO + HCl + 2NaClO2 2ClO2↑+ 2NaCl + H2O。
(3)Clˉ存在时会催化 ClO2的生成,若无乙装置,则丙装置内产生 ClO2的速率明显加快。乙装置中试剂瓶内的液体是__________。戊装置的作用是_______________________。
(4)戊装置烧杯中 NaOH 溶液吸收 ClO2后,生成了 ClO![]() 、ClO
、ClO![]() ,该反应的离子方程式是_______________________________________。
,该反应的离子方程式是_______________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】只用一种试剂就能鉴别出NH4NO3、Na2CO3、(NH4)2CO3三种溶液,该试剂可应选用
A.Ba(OH)2B.BaCl2C.NaOHD.HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是日常生活中两种常见的金属,铝和铁的化合物是中学化学中常见的基础物质。请回答下列有关问题:
(1)氧化铝是一种_____氧化物(填“酸性”“碱性”或“两性”);
(2)实验室制备氢氧化铝时,最好向铝盐溶液中加入_____。(填“氨水”或“氢氧化钠溶液”);
(3)还原铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g) ![]() X+4H2,试推测X的化学式为_____。
X+4H2,试推测X的化学式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对分别盛有不同无色溶液①②③④四支试管进行如下操作,现象和结论对应正确的是
操作 | 现象 | 结论 | |
A | 向①中先滴加BaCl2溶液再滴加HCl溶液 | 生成白色沉淀 | 原溶液中有SO42- |
B | 向②(盛KI淀粉溶液)中通入少量的Cl2 | 溶液变蓝色 | Cl2与淀粉发生显色反应 |
C | 向③中溶液先滴加H2O2溶液,再滴加KSCN溶液 | 溶液变红色 | 原溶液中含有Fe2+ |
D | 向④中滴加浓NaOH溶液,加热,将湿润红色石蕊试纸置于试管口 | 试纸变蓝 | 原溶液中有NH4+ |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com