
【题目】铝和铁是日常生活中两种常见的金属,铝和铁的化合物是中学化学中常见的基础物质。请回答下列有关问题:
(1)氧化铝是一种_____氧化物(填“酸性”“碱性”或“两性”);
(2)实验室制备氢氧化铝时,最好向铝盐溶液中加入_____。(填“氨水”或“氢氧化钠溶液”);
(3)还原铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g) ![]() X+4H2,试推测X的化学式为_____。
X+4H2,试推测X的化学式为_____。
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
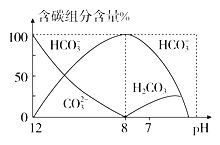
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=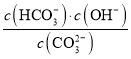 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物对应的水化物中酸性较强的是____(写出化学式)。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程:___。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ 的热量,请写出表示X2燃烧热的热化学方程式:_____。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为___;若B为常见家用消毒剂的主要成分,则B的化学式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列溶液:100mL 2 mol·L-1 KCl溶液、100 mL 1mol·L-1 CaCl2溶液和200 mL 1mol·L-1FeCl3溶液,上述三种溶液中Cl-物质的量浓度之比为
A.1 :1:3B.1 :1:1C.2 :2:3D.1 :2:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
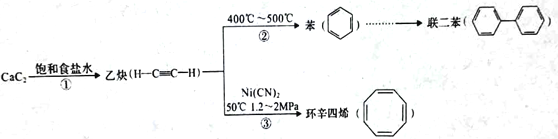
(1)反应①类似盐的水解,写出CaC2的电子式_________。
(2)苯是由哪位科学家首先发现的________,苯分子中有三个氢原子被-Br、-Br、-OH取代得到的芳香族化合物有_____种。将苯分子中的一个碳原子换成一个氮原子,得到一种类似苯环结构的稳定有机物,则此有机物的相对分子质量为________。
(3)写出反应③的化学反应方程式并注明反应类型__________。
(4)联二苯的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑥六种元素在元素周期表中的位置。
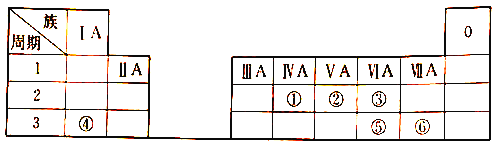
请回答下列问题:
(1) ①元素原子的质子数是_________。
(2)②元素的最简单氢化物的分子式是_______。
(3)③和⑤两种元素的非金属性: ③___⑤(填“>”“<”或“=”);
(4)④和⑥两种元素的最高价氧化物对应的水化物相互反应的离子方程式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图表示A~E五种物质间的相互转化关系,其中A为淡黄色固体,B为单质。回答下列问题:

(1)写出各物质的化学式:A.___,B.___,C.____,D.____,E.____。
(2)写出B→C、D→E反应的离子方程式:
B→C:____________________________________________________________;
D→E:____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(题文)(题文)PHB塑料是一种在微生物作用下可降解成无机物的环保型塑料,工业上可用异戊二烯合成:

已知:

(—R1、—R2、—R3、—R均为烃基)
请回答下列问题:
(1)A用系统命名法命名为_____,D中官能团的名称是_______。
(2)反应①的反应类型为_______________。
(3)B与H2反应后的产物的结构简式为![]() ,则B的结构简式为_____。
,则B的结构简式为_____。
(4)写出反应④的化学方程式:_________________________________。
(5)C的同分异构体X满足下列条件:
①能发生水解反应和银镜反应;②1个分子中含有2个碳氧双键。则符合条件的X共有______种。
另一种同分异构体Y能与碳酸钠溶液反应放出气体,能发生银镜反应,核磁共振氢谱共有四组峰且峰面积之比为1∶1∶2∶2,则Y的结构简式为_________。
(6)参照PHB的上述合成路线,设计一条由D为起始原料制备 的合成路线(其他试剂任选)______________。
的合成路线(其他试剂任选)______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与预期实验目的或实验结论一致的是( )
选项 | 实验操作及现象 | 实验目的或结论 |
A | 向Fe(NO3)2溶液中滴入用H2SO4酸化的H2O2溶液,则溶液变黄 | 氧化性:H2O2>Fe3+ |
B | 向某溶液加入HCl酸化的BaCl2溶液有沉淀产生 | 说明此溶液中一定含SO42﹣ |
C | 向Na2SiO3溶液中通入CO2出现浑浊 | 非金属性强弱:C>Si |
D | 向2 mL 0.1 mol·L-1 Na2S溶液中滴入几滴0.1 mol·L-1 ZnSO4溶液,有白色沉淀生成;再加入几滴0.1mol·L-1 CuSO4溶液,则又有黑色沉淀生成 | 溶度积(Ksp):ZnS>CuS |
A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com