
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
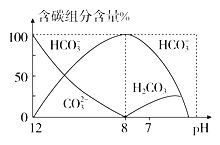
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=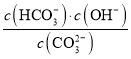 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
【答案】 < 7 NaHCO3+H2O![]() H2CO3+NaOH AD HCO
H2CO3+NaOH AD HCO![]() 、H2CO3 10
、H2CO3 10
【解析】试题分析:由表中数据可知,NaX的水解程度介于NaHCO3和之间Na2CO3,所以在相同条件下相关物质酸性由强到弱的顺序为CH3COOH> H2CO3>HX >HCO3.
(1)①中由水电离出的c(OH-)=1![]() mol/L,②中由水电离出的c(H+)= 1
mol/L,②中由水电离出的c(H+)= 1![]() mol/L,所以,①中由水电离出的c(OH-) <②中由水电离出的c(H+)。
mol/L,所以,①中由水电离出的c(OH-) <②中由水电离出的c(H+)。
(2)③中NaHCO3完全电离为钠离子和碳酸氢根,碳酸氢根有少量电离为碳酸根,也有少量水解为碳酸,溶液中还有水的电离平衡,所以溶液中共存在钠离子、碳酸氢根离子、碳酸根离子、氢离子、氢氧根离子、碳酸分子、水分子等7种粒子,pH=8.4的原因是因为碳酸氢水解使溶液呈碱性,化学方程式为NaHCO3+H2O![]() H2CO3+NaOH ;
H2CO3+NaOH ;
(3)A.醋酸铵可以双水解,在相同条件下其水解程度比氯化铵大,所以①中c(NH4+)大于②的,A正确;B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液都呈中性,虽然两溶液中的溶质的物质的量相等,因为CH3COONH4发生了双水解,所以CH3COONH4中离子总数较小,B不正确;C.等体积的③和⑤形成的混合溶液中,存在物料守恒:c(H2CO3)+c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1,C不正确;D.因为HX的电离常数较小,所以HX的物质的量浓度较大,将pH相同的CH3COOH和HX溶液加水稀释相同倍数后,两溶液的pH均变大,但是HX溶液的pH变化小,D正确。综上所述,说法正确的是AD。
(4)①由图中信息可知,当pH=7时,溶液中含碳元素的主要微粒为HCO![]() 、H2CO3;
、H2CO3;
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=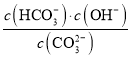 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,由Kh可以求出
)=2∶1时,由Kh可以求出![]() 1.0×10-4 mol·L-1,所以,
1.0×10-4 mol·L-1,所以, ![]() 1.0×10-10 mol·L-1,溶液的pH=10。
1.0×10-10 mol·L-1,溶液的pH=10。


科目:高中化学 来源: 题型:
【题目】已知:将Cl2通入适量NaOH溶液,产物中可能有NaCl、NaClO、NaClO3,且![]() 的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
的值与温度高低有关。当n(NaOH)=a mol时,下列有关说法错误的是
A. 参加反应的氯气的物质的量等于a/2 mol
B. 改变温度,产物中NaClO3的最大理论产量为a/7 mol
C. 改变温度,反应中转移电子的物质的量ne的范围:a/2 mol≤ne≤5a/6 mol
D. 若某温度下,反应后![]() =11,则溶液中
=11,则溶液中![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应属于氧化还原反应的是
A. H2O+SO3=H2SO4 B. CH4+2O2![]() CO2+2H2O
CO2+2H2O
C. 2Fe(OH)3![]() Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于甲烷及其反应产物的叙述中正确的是
A. 甲烷分子中的H-C-H键的键角为90°B. CH2Cl2具有正四面体结构
C. CHCl3只代表一种物质D. CH2Br2可能有两种结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用图装置(气密性好)研究钠与氯气的反应。

实验步骤:
①将一定量浓盐酸滴在KMnO4粉末上,立即产生黄绿色气体。
②待黄绿色气体均匀充满集气瓶时,关闭止水夹。
③再向钠粒上滴2滴水,片刻后钠燃烧,产生白烟,白色固体附着在集气瓶内壁上。
(1)步骤①,黄绿色气体是氯气,则KMnO4的作用是__________(填“氧化剂”或“还原剂”)。
(2)步骤③,引起钠燃烧的原因是____________。
(3)生成白色固体的化学方程式是______________。
(4)结合离子方程式说明NaOH溶液的作用是_______________。
(5)实验结束后,甲同学在安全、环保的理念指导下,仅用上图装置就完成了集气瓶内残余氯气的处理,其操作是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值。下列说法正确的是
A. 密闭容器中2 mol NO与1 mol O2充分反应,产物的分子数为2NA
B. 某密闭容器中 0.1 mol N2和 0.3 mol H2在一定条件下充分反应,转移电子的数目为0.6NA
C. 50 mL 18.4 mol/L 浓硫酸与足量铜微热反应,生成SO2分子的数目为0.46NA
D. 常温常压下,1 mol O2与SO2的混合气体中含氧原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】波义耳在《怀疑的化学家》一书中说:“在火的单独作用下,玻璃容器的水银会丧失其原有的银色,变成一种红色物体;而无须使用任何附加试剂,用这种红色物体也可以得到汞”。 该过程可表示为"2Hg+O2![]() 2HgO”下列说法错误的是
2HgO”下列说法错误的是
A. 利用该反应可粗略测定空气中氧气的含量
B. 波义耳所描述的上述变化是一个可逆的化学反应
C. 水银温度计如果破损,可将硫粉洒在散落的水银上防止污染
D. 制备Hg单质可以采用热分解法使其氧化物在高温下分解制得
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和铁是日常生活中两种常见的金属,铝和铁的化合物是中学化学中常见的基础物质。请回答下列有关问题:
(1)氧化铝是一种_____氧化物(填“酸性”“碱性”或“两性”);
(2)实验室制备氢氧化铝时,最好向铝盐溶液中加入_____。(填“氨水”或“氢氧化钠溶液”);
(3)还原铁粉与水蒸气反应的化学方程式为3Fe+4H2O(g) ![]() X+4H2,试推测X的化学式为_____。
X+4H2,试推测X的化学式为_____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com