
【题目】下列反应属于氧化还原反应的是
A. H2O+SO3=H2SO4 B. CH4+2O2![]() CO2+2H2O
CO2+2H2O
C. 2Fe(OH)3![]() Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
Fe2O3+3H2O↑ D. NaHCO3+NaOH=Na2CO3+H2O
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案科目:高中化学 来源: 题型:
【题目】钒的化合物常用于制作催化剂和新型电池。回答下列问题:
(1)金属钒可由铝热反应制得。已知25℃、101 kPa时,
4A1(s)+3O2(g)=2Al2O3 (s) △H1=a kJ·mol-1
4V(s) +5O2 (g)=2V2O5(s) △H2=b kJ·mol-1
则用铝热反应冶炼金属V(s)的热化学方程式为_____________________。
⑵V2O5为橙黄至砖红色固体,无味、有毒,微溶于水,是许多有机和无机反应的催化剂。下图表示的是25℃时,部分含钒微粒的存在形式、浓度和存在的pH范围(其余可溶性微粒均未标出),图中“[V]”表示含钒微粒的浓度,虚线表示[V]或pH的范围尚未准确确定。
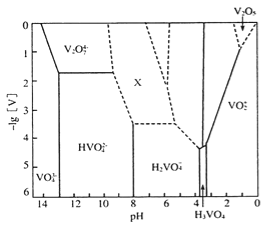
①V2O5溶于足量2mol L-1NaOH溶液中,发生反应的离子方程式为_________________,向反应后的溶液中,滴加硫酸溶液至过量(pH<1)的过程中,开始溶液保持澄淸,滴加一段时间后,观察到有橙黄色沉淀产生,继续滴加硫酸溶液,沉淀又消失。则沉淀消失过程中发生反应的化学方程式为_______________。
②上述滴加硫酸溶液的过程中,先后发生如下反应:

则“X所示区域溶液中的离子”不可能是___________(填序号);
a.V3O93- b.V4O103- c. V4O124-
(3)V2O5是反应2SO2+O2![]() 2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
2SO3的催化剂。其他条件不变,加入V2O5后,该反应的速率加快的原因是_______________;恒温恒压下,加人V2O5,该反应的平衡常数________________ (填“增大”、 “减小”或“不变”);
(4)下图所示为可充电的全钒液流电池构造示意图,该电池中的隔膜只允许H+通过。电池放电时,负极区溶液的pH将_____________(填“增大”、“减小”或“不变”),电池充电时,阳极的电极反应式为_____________________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室有一包白色固体,可能含有 Na2CO3、NaHCO3 和 NaCl 中的一种或多种。下列根据实验事实 得出的结论正确的是
A. 取一定量固体,溶解,向溶液中加入适量 CaO 粉末,充分反应后观察到有白色沉淀生成,说 明原固体中一定含有 Na2CO3
B. 取一定量固体,溶解,向溶液中通入足量的 CO2,观察到有晶体析出,说明原固体中一定含有Na2CO3
C. 取一定量固体,溶解,向溶液中滴加适量 AgNO3 溶液,观察到有白色沉淀生成,说明原固体 中一定含有 NaCl
D. 称取 4.75 g 固体,加热至恒重,质量减少了 0.930 g。用足量稀盐酸溶解残留固体,充分反应 后,收集到 1.10 g 气体,说明原固体中含有 Na2CO3、NaHCO3 和 NaCl 三种,且它们的物质的 量之比为 1∶3∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关生物体内化合物的叙述,正确的是( )
A. 所有细胞中都含有蛋白质和磷脂
B. N是组成细胞内各种有机物的必需元素
C. 氨基酸脱水缩合产生水,水中的氢都来自氨基
D. 细胞核内的核酸只含脱氧核糖,细胞质中的核酸只含核糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向MgCl2、Al2(SO4)3的混合済液中不断加入NaOH溶液,得到沉淀的物质的量与加入NaOH溶液体积的关系如右图所示,则原溶液中SO42—与Cl—的物质的量之比是( )

A. 1:2 B. 1:1 C. 2:3 D. 3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组的同学利用MnO2、浓盐酸反应来制取干燥的氯气并验证其有无漂白性,所用装置如图所示(可重复使用,不含制气装置)。下列说法正确的是( )

A. 按气流流动的先后顺序,装置连接顺序依次为DACBE
B. 按气流流动的先后顺序,装置连接顺序依次为DABAE
C. 装置E的主要用途是制备NaClO
D. 若实验中使用到装置C且有色布条褪色,则说明湿润的氯气有漂白性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在两份相同的H2SO4溶液中,分别滴入物质的量浓度相等的Ba(OH)2、NaOH溶液,其导电能力随滴入溶液体积变化的曲线如下图所示,下列分析不正确的是

A. ①代表滴加Ba(OH)2溶液的变化曲线 B. a、c两点,溶液中均大量存在H+和SO42-
C. b、d两点对应的溶液均显中性 D. e点,两溶液中含有相同量的OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,物质的量浓度均为0.1molL﹣1的几种盐溶液的pH如表:
序号 | ① | ② | ③ | ④ | ⑤ |
溶液 | NH4Cl | CH3COONH4 | NaHCO3 | NaX | Na2CO3 |
pH | 5 | 7 | 8.4 | 9.7 | 11.6 |
(1)①中由水电离出的c(OH-)________(填“>”“=”或“<”)②中由水电离出的c(H+)。
(2)③中共存在______种粒子,pH=8.4的原因:_______________________________;
(3)下列说法正确的是_____。
A.c(NH4+):①>②
B.物质的量浓度和体积均相等的NaCl和CH3COONH4两种溶液中,离子总数相等
C.等体积的③和⑤形成的混合溶液中:c(HCO3﹣)+c(CO32﹣)=0.1molL﹣1
D.将pH相同的CH3COOH和HX溶液加水稀释相同倍数,HX溶液的pH变化小
(4)常温下在20 mL 0.1 mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。
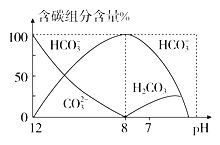
回答下列问题:
①当pH=7时,溶液中含碳元素的主要微粒为________
②已知在25 ℃时,CO![]() 水解反应的平衡常数Kh=
水解反应的平衡常数Kh=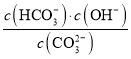 =2.0×10-4 mol·L-1,当溶液中c(HCO
=2.0×10-4 mol·L-1,当溶液中c(HCO![]() )∶c(CO
)∶c(CO![]() )=2∶1时,溶液的pH=______________。
)=2∶1时,溶液的pH=______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素X、Y、Z、M、N均为短周期主族元素,且原子序数依次增大。已知Y原子最外层电子数与核外电子总数之比为3∶4;M原子最外层电子数与次外层电子数之比为3∶4;N-、Z+、X+离子的半径逐渐减小;化合物XN常温下为气体。据此回答:
(1)M、N的最高价氧化物对应的水化物中酸性较强的是____(写出化学式)。
(2)Z与M可形成常见固体化合物C,用电子式表示C的形成过程:___。
(3)已知通常状况下1g X2在Y2中完全燃烧放出a kJ 的热量,请写出表示X2燃烧热的热化学方程式:_____。
(4)X与Y、X与M均可形成18电子分子,这两种分子在水溶液中反应有黄色沉淀生成,写出该反应的化学方程式:_______。
(5)化合物A、B均为由上述五种元素中的任意三种元素组成的强电解质,且两种物质水溶液的酸碱性相同,组成元素的原子数目之比为1∶1∶1,A溶液中水的电离程度比在纯水中小。则化合物A中的化学键类型为___;若B为常见家用消毒剂的主要成分,则B的化学式是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com