
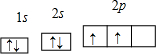

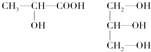
 ;
; ;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;
;Al;Cl;1s22s22p63s23p63d104s1;第四周期第ⅠB族;ds;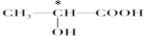 中标“*”为手性碳原子,
中标“*”为手性碳原子,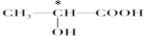 ;
;

科目:高中化学 来源: 题型:
| 元素 | 相关信息 |
| X | X的氢化物分子中含10个电子,呈正四面体结构 |
| Y | Y与X同周期,其最高价氧化物对应的水化物是一种强氧化性酸 |
| Z | 第三周期元素中,Z电负性最小 |
| W | W的基态原子核外M能层上填满了电子,N能层只有1个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 电离能/kJ?mol-1 | I1 | I2 | I3 | I4 |
| A | 500 | 4600 | 6900 | 9500 |
| B | 740 | 1500 | 7700 | 10500 |
| R | 580 | 1800 | 2700 | 11600 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
| 3 |
| 4 |
| 1 |
| 2 |
| 3 |
| 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 元素 | 结构、性质等信息 |
| X | 构成有机物的主角,该元素的一种氧化物和气态氢化物都是典型的温室气体. |
| Y | 短周期中(除稀有气体外)原子半径最大的元素,该单质液态时可用作核反应堆的传热介质. |
| Z | 与Y同周期,其最高价氧化物的水化物呈两性. |
| M | 海水中除氢、氧元素外含量最多的元素,其单质或化合物也是自来水生产过程中常用的消毒杀菌剂. |
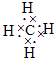
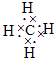
| ||
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 520 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
| 元素 | H | Li | Be | B | C | N | O | F |
| 电负性 | 2.1 | 1.0 | 1.5] | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| 元素 | Na | Mg | Al | Si | P | S | Cl | K |
| 电负性 | 0.9 | 1.2 | 1.5 | 1.7 | 2.1 | 2.3 | 3.0 | 0.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com