
【题目】实验室制备少量乙酸乙酯的装置如图所示。下列有关该实验说法正确的是
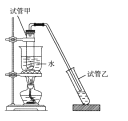
A.乙酸乙酯的沸点小于100℃
B.反应前,试管甲中先加入浓硫酸,后加入适量冰酸醋和乙醇
C.试管乙中应盛放NaOH浓溶液
D.实验结束后,将试管乙中混合液进行蒸发结晶可得到乙酸乙酯
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,2.24L苯中含C-H数目为0.6 NA
B.常温下,9.2gNO2和N2O4的混合气体中含有的氮原子数目为0.2NA
C.常温下,1.0LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA
D.在反应KClO3+6HCl=KCl+3Cl2↑+3H2O中,每生成3molCl2转移的电子数为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上采用酸性高浓度含砷废水(砷主要以亚砷酸H3AsO3形式存在)提取中药药剂As2O3。工艺流程如下:
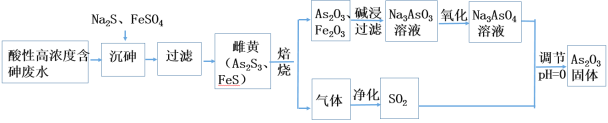
回答下列问题:
(1)已知砷元素与N同一主族,原子比N原子多两个电子层,则砷元素的原子序数为________,“沉砷”中所用Na2S的电子式为_____________。
(2)已知:As2S3与过量的S2-存在以下反应:As2S3(s)+3S2-(aq) ![]() 2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
2AsS33- ;“沉砷”中FeSO4的作用是___________________________。
(3)“焙烧”过程中由于条件的原因,生成的三氧化二铁中混有四氧化三铁,证明四氧化三铁存在的试剂是_________________________________。(写名称)
(4)调节pH=0时,由Na3AsO4制备As2O3的离子方程式为:_______________。
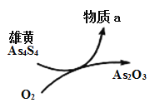
(5)一定条件下,用雄黄(As4S4)制备As2O3的转化关系如图所示。若反应中,1molAs4S4(其中As元素的化合价为+2价)参加反应时,转移28mole-,则物质a为___________。(填化学式)
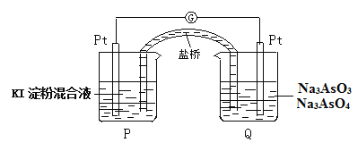
(6)某原电池装置如图,电池总反应为:AsO43-+2I-+H2O![]() AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
AsO33-+I2+2OH-。当P池中溶液由无色变成蓝色时,正极上的电极反应式为____________________________。一段时间后电流计指针不发生偏转。欲使指针偏转方向与起始时相反,可采取的措施是____________(举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。又知AgCl的Ksp=1.8×10-10。下列说法不正确的是( )
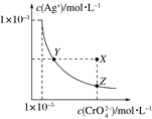
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL 0.01 mol·L-1KCl和0.01 mol·L-1K2CrO4的混合溶液中,Cl-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,有关物质的电离平衡常数如下:

(1)电解质由强至弱顺序为___(用化学式表示,下同)。
(2)常温下,0.02mol·L-1的CH3COOH溶液的电离度约为___,体积为10 mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者___后者(填“>”、“<”或“=”)。
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为_____。
(4)NaHSO3溶液显酸性的原因_____(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家设计了一种将电解饱和食盐水与电催化还原CO2相耦合的电解装置如图所示。下列叙述错误的是
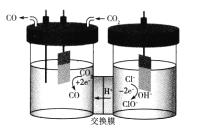
A.理论上该转化的原子利用率为100%
B.阴极电极反应式为![]()
C.Na+也能通过交换膜
D.每生成11.2 L(标况下)CO转移电子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷酸铝(AlPO4)是一种用途广泛的材料,可在玻璃生产过程中充当助熔剂,作陶瓷或牙齿的黏合剂等。以磷硅渣[主要成分为Ca3(PO4)2、Al2O3、SiO2和V2O5等]为原料制备磷酸铝的工艺流程如图所示:

请回答下列问题:
(1)浸渣中含有SiO2,试写出SiO2的一种重要用途__;酸浸中磷元素主要转化为H3PO4,该反应的化学方程式为__。
(2)生石灰除了调节pH外,另一作用是__。
(3)滤液中钒元素以V3O93-形式存在,V3O93-易水解为[VO3(OH)]2-,该水解反应的离子方程式为__。
(4)碱浸时,粗磷酸铝转化为可溶性溶质,则可溶性溶质分别是__(填化学式)。
(5)实验测得pH、反应温度与时间对碱浸时固相中P、Al含量w%的影响如图所示:

则最优反应条件是__。
(6)在物质的量浓度分别为0.01mol·L-1的CaCl2和AlCl3的混合溶液中加入等体积的Na3PO4溶液,若A13+恰好沉淀完全,即溶液中c(A13+)=1.0×10-5mol·L-1,此时AlPO4沉淀中__(填“是”或“否”)混有Ca3(PO4)2。[已知AlPO4、Ca3(PO4)2的Ksp分别为6.3×10-19、2.0×10-29]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫氰化钾可用于农药、医药、电镀、化学试剂、检定铁离子、铜和银等。某兴趣小组同学在实验室模拟工业制备硫氰化钾(KSCN),实验装置如图所示。
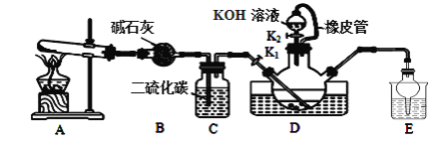
实验步骤如下:
(1)制备NH4SCN溶液:CS2+2NH3![]() NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
NH4SCN+H2S,该反应进行的比较缓慢,NH3不溶于CS2。
①实验前,应进行的操作是__;三颈烧瓶内盛放有一定量的CS2、水和催化剂。三颈烧瓶的下层CS2液体必须浸没导气管口,目的是__。
②实验开始时打开K1,加热装置A、D,缓慢地向装置D中充入气体。装置A中发生反应的化学方程式是__,装置C的作用可能是__。
(2)制备KSCN溶液:移去装置A处的酒精灯,关闭K1,打开K2,利用耐碱分液漏斗边加液边加热,则此时装置D中发生反应的化学方程式是__。
(3)制备KSCN晶体:先滤去三颈烧瓶中的固体催化剂,再减压蒸发浓缩,冷却结晶,___,得到硫氰化钾晶体。
(4)测定KSCN的含量:称取10.00g样品配成1000mL溶液,量取25.00mL溶液于锥形瓶中,并加入几滴Fe(NO3)3溶液,用0.1000mol·L-1AgNO3标准溶液滴定。经过3次平行试验,达到滴定终点时,消耗AgNO3标准溶液的体积平均为20.00mL。滴定反应的离子方程式为SCN-+Ag+=AgSCN↓。
①判断达到滴定终点的方法是__。
②样品中KSCN的质量分数为__(KSCN的摩尔质量为97g·mol-1,保留4位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钻蓝(含Co、Al、O三种元素)是一种带绿光的蓝色颜料。固相法是制备钴蓝颜料方法之一,即将钴、铝的氧化物(或是两者的氢氧化物)按一定比例负载于石墨烯上,然后在马弗炉中高温灼烧、冷却、研磨。回答下列问题:
(1)基态钴原子核外电子排布式为[Ar]__。
(2)下列O原子电子排布图表示的状态中,能量最低的是__(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)已知Co的活泼性与Fe相近,Co、Al、O的电负性从大到小的顺序为__。
(4)石墨烯的结构如图甲所示。
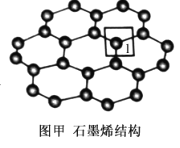
①每个石墨烯分子中,C(如图中1位置处)可形成σ键的个数为__,其杂化类型为___。
②C原子在形成化合物时,其键型以共价键为主,原因是__。
(5)钴蓝晶胞结构如图乙所示,其立方晶胞由4个I型和4个II型小立方体构成。

①钴蓝的化学式为__。
②已知NA为阿伏加德罗常数的值,钴蓝晶体的密度为__g·cm-3(列计算式即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com