
【题目】钻蓝(含Co、Al、O三种元素)是一种带绿光的蓝色颜料。固相法是制备钴蓝颜料方法之一,即将钴、铝的氧化物(或是两者的氢氧化物)按一定比例负载于石墨烯上,然后在马弗炉中高温灼烧、冷却、研磨。回答下列问题:
(1)基态钴原子核外电子排布式为[Ar]__。
(2)下列O原子电子排布图表示的状态中,能量最低的是__(填字母)。
A.![]() B.
B.![]()
C.![]() D.
D.![]()
(3)已知Co的活泼性与Fe相近,Co、Al、O的电负性从大到小的顺序为__。
(4)石墨烯的结构如图甲所示。
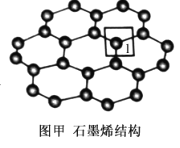
①每个石墨烯分子中,C(如图中1位置处)可形成σ键的个数为__,其杂化类型为___。
②C原子在形成化合物时,其键型以共价键为主,原因是__。
(5)钴蓝晶胞结构如图乙所示,其立方晶胞由4个I型和4个II型小立方体构成。

①钴蓝的化学式为__。
②已知NA为阿伏加德罗常数的值,钴蓝晶体的密度为__g·cm-3(列计算式即可)。
【答案】3d74s2 A O>Co>Al 1.5 sp2 C有四个价电子且半径小,难以通过得失电子达到稳定结构 CoAl2O4 ![]()
【解析】
(1)根据构造原理写出基态钴原子的核外电子排布式;
(2)原子核外电子排布中,电子所占的轨道能级越低,低能级轨道上电子数目越多,该原子能量越低;
(3)一般非金属元素的电负性大于金属元素的电负性,金属性越强,电负性越小;
(4)①利用均摊法计算,根据杂化轨道理论分析C原子的杂化方式;
②根据C原子的价电子排布以及原子结构分析;
(5)①先以I型和II型合起来的长方体为重复单元,计算该重复单元中Co、Al、O原子个数,再计算晶胞内Co、Al、O个数,进而化简为最简整数比,得到化学式;
②先计算该晶胞体积、和晶胞质量,进而计算钴蓝晶体的密度。
(1)钴原子为27号元素,根据构造原理,可写出基态钴原子的核外电子排布式为[Ar]3d74s2,故答案为:3d74s2;
(2)原子核外电子排布中,如果电子所占的轨道能级越低,该原子能量越低,低能级轨道上电子数目越多,该原子能量越低,能级的能量高低顺序是1s<2s<2p,其中核外电子按照构造原理排布时,原子处于基态,能量最低,A项排布是按照构造原理进行的,因此能量最低,故答案为:A;
(3)已知Co的活泼性与Fe相近,则Co的金属性弱于Al,相反,Co的电负性比Al的电负性大,一般非金属元素的电负性大于金属元素的电负性,则三者的电负性从大到小的顺序为O>Co>Al,故答案为:O>Co>Al;
(4)①根据石墨烯的结构图,利用均摊法可知,每个石墨烯分子中,C原子可形成σ键的个数为![]() ,石墨烯是一种由单层碳原子构成的平面结构,碳原子的杂化类型为sp2,故答案为:1.5;sp2;
,石墨烯是一种由单层碳原子构成的平面结构,碳原子的杂化类型为sp2,故答案为:1.5;sp2;
②由于C有四个价电子且半径小,难以通过得失电子达到稳定结构,则C原子在形成化合物时,其键型以共价键为主,故答案为:C有四个价电子且半径小,难以通过得失电子达到稳定结构;
(5)①以I型和II型合起来的长方体为重复单元,该重复单元中Co原子个数=![]() 个,同时含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有8个Co、16个Al和32个O,则Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4,故答案为:CoAl2O4;
个,同时含有4个Al和8个O,晶胞内有4个I型和II型合起来的长方体,因而晶胞内总计有8个Co、16个Al和32个O,则Co、Al、O个数比为8:16:32=1:2:4,化学式为CoAl2O4,故答案为:CoAl2O4;
②该晶胞体积=(2a×107cm)3,晶胞相当于有8个“CoAl2O4”,故晶胞质量=![]() ,故钴蓝晶体的密度
,故钴蓝晶体的密度![]() g/cm3,故答案为:
g/cm3,故答案为:![]() 。
。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】实验室制备少量乙酸乙酯的装置如图所示。下列有关该实验说法正确的是
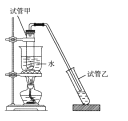
A.乙酸乙酯的沸点小于100℃
B.反应前,试管甲中先加入浓硫酸,后加入适量冰酸醋和乙醇
C.试管乙中应盛放NaOH浓溶液
D.实验结束后,将试管乙中混合液进行蒸发结晶可得到乙酸乙酯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如下:
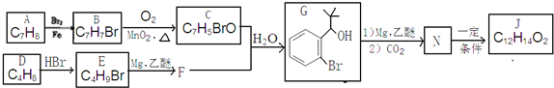
已知:①R-Br![]()
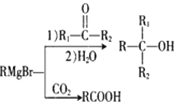
②E的核磁共振氢谱只有一组峰;
③C能发生银镜反应;
④J是一种酯,分子中除苯环外还含有一个五元环。
回答下列问题:
(1)由A生成B的化学方程式为__________,其反应类型为__________;
(2)D的化学名称是__________,由D生成E的化学方程式为__________;
(3)J的结构简式为__________;
(4)G的同分异构体中核磁共振氢谱有4组峰且能与FeCl3溶液发生显色反应的结构简式__________(写出一种即可);
(5)由甲醛和化合物A经下列步骤可得到2—苯基乙醇:A![]() K
K![]() L
L![]()
![]() 。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
。反应条件1为__________;反应条件2所选择的试剂为__________;L的结构简式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是用一种新型锂电池电解处理含NH4+的工业废水的装置图。处理过程中,NH4+转化为可参与大气循环的气体。下列说法正确的是( )

A.废水处理过程中,Y电极上发生氧化反应
B.废水处理过程中,X电极附近溶液酸性减弱
C.废水处理过程中,W电极反应式为O2+4e-+4H+=2H2O
D.若消耗7gLi则质子交换膜左侧电解质溶液减少![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】炒过菜的铁锅未及时洗净(残液中含NaCl),不久便会因被腐蚀而出现红褐色锈斑。腐蚀原理如图所示,下列说法正确的是
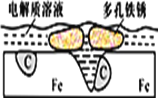
A. 腐蚀过程中,负极是C
B. Fe失去电子经电解质溶液转移给C
C. 正极的电极反应式为4OH―-4e-==2H2O+O2↑
D. C是正极,O2在C表面上发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为以Pt为电极的氢氧燃料电池的工作原理示意图,稀H2SO4溶液为电解质溶液。下列有关说法不正确的是

A. a极为负极,电子由a极经外电路流向b极
B. a极的电极反应式:H2-2e-===2H+
C. 电池工作一段时间后,装置中c(H2SO4)增大
D. 若将H2改为CH4,消耗等物质的量的CH4时,O2的用量增多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01mol·L-1HA溶液中逐滴加入0.02mol·L-1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计)。回答下列问题:
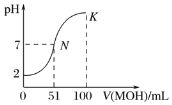
(1)由图中信息可知HA为________(填“强”或“弱”)酸,MOH为_________(填“强”或“弱”)碱。
(2)常温下一定浓度的MA稀溶液的pH=a,则a______(填“>”“<”或“=”)7,用离子方程式表示其原因:__________________,此时溶液中由水电离出的c(OH-)=____________。
(3)K点对应的溶液中,c(M+)+c(MOH)________(填“>”“<”或“=”)2c(A-),溶液中离子浓度的大小关系:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钛(Ti)是一种具有许多优良性能的金属,钛和钛合金被认为是21世纪的重要金属材料。
(1)Ti(BH4)2是一种过渡元素硼氢化物储氢材料。
①Ti2+基态电子排布式可表示为_____。
②与BH4-互为等电子体的阳离子的化学式为_____。
③H、B、Ti原子的第一电离能由小到大的顺序为_____。
(2)二氧化钛(TiO2)是常用的、具有较高催化活性和稳定性的光催化剂,常用于污水处理。纳米TiO2催化的一个实例如图所示。
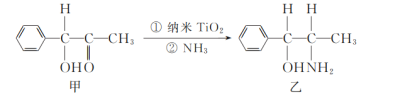
化合物乙的分子中采取sp3杂化方式的原子个数为_____。
(3)水溶液中并没有[Ti(H2O)6)]4+离子,而是[Ti(OH)2(H2O)4]2+离子,1mol[Ti(OH)2(H2O)4]2+中σ键的数目为____。
(4)氮化钛(TiN)具有典型的NaCl型结构,某碳氮化钛化合物,结构是用碳原子取代氮化钛晶胞(结构如图)顶点的氮原子,则此碳氮化钛化合物的化学式是_____。
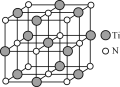
查看答案和解析>>
科目:高中化学 来源: 题型:
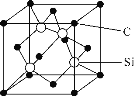
【题目】硼、硅、硒等元素及其化合物用途广泛。请回答下列问题:
(1)基态硒原子的价电子排布式为_______;SeO2常温下为白色晶体,熔点为340~350℃,315℃时升华,则SeO2固体为________晶体。
(2)在硼、硅、硒的气态氢化物中,其立体构型为正四面体的是_______(填化学式),在硅的氢化物中共用电子对偏向氢元素,氢气与硒反应时单质硒是氧化剂,则硒与硅的电负性大小为Se_____Si(填“>”或“<”)。
(3)在周期表的第二周期中,第一电离能介于硼元素和氮元素之间的元素有_____种。
(4)硼元素具有缺电子性(价电子数少于价层轨道数),其化合物可与具有孤对电子的分子或离子生成配合物,如BF3能与NH3反应生成BF3·NH3,BF3·NH3中B与N之间形成______键;NH3中N原子的杂化轨道类型为______,写出与NH3等电子体的一种离子符号________。
(5)金刚砂(SiC)的摩氏硬度为9.5,其晶胞结构如图所示。在SiC中,每个Si原子周围距离最近的Si原子数目为________;若金刚砂的密度为ρg·cm-3,NA表示阿伏加德罗常数的值,则晶胞中碳原子与硅原子的最近距离为________pm。(用含ρ和NA的式子表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com